医薬品情報
| 総称名 | ナルティーク |
|---|---|
| 一般名 | リメゲパント硫酸塩水和物 |
| 欧文一般名 | Rimegepant Sulfate Hydrate |
| 製剤名 | リメゲパント硫酸塩水和物OD錠 |
| 薬効分類名 | 経口CGRP受容体拮抗薬 |
| 薬効分類番号 | 1190 |
| KEGG DRUG |
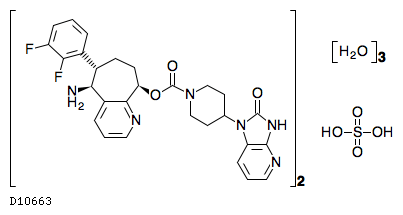
D10663
リメゲパント硫酸塩水和物
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年9月 作成(第1版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ナルティークOD錠75mg | Nurtec OD tablets 75mg | ファイザー | 11900C1F1029 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
片頭痛発作の急性期治療及び発症抑制
5. 効能または効果に関連する注意
<片頭痛発作の急性期治療>
5.1 本剤は国際頭痛学会による片頭痛診断基準により「前兆のない片頭痛」あるいは「前兆のある片頭痛」と確定診断が行われた場合にのみ投与すること。
特に以下のような患者は、本剤投与前に問診、診察、検査を十分に行い、頭痛の原因を確認してから投与すること。
特に以下のような患者は、本剤投与前に問診、診察、検査を十分に行い、頭痛の原因を確認してから投与すること。
・今までに片頭痛と診断が確定したことのない患者
・片頭痛と診断されたことはあるが、片頭痛に通常見られる症状や経過とは異なった頭痛及び随伴症状のある患者
<片頭痛発作の発症抑制>
5.2 十分な診察を実施し、前兆のある又は前兆のない片頭痛の発作が月に複数回以上発現している、又は慢性片頭痛であることを確認した上で本剤の適用を考慮すること。
5.3 最新のガイドライン等を参考に、非薬物療法、片頭痛発作の急性期治療等を適切に行っても日常生活に支障をきたしている患者にのみ投与すること。
6. 用法及び用量
<片頭痛発作の急性期治療>
通常、成人にはリメゲパントとして1回75mgを片頭痛発作時に経口投与する。
<片頭痛発作の発症抑制>
通常、成人にはリメゲパントとして75mgを隔日経口投与する。
7. 用法及び用量に関連する注意
<効能共通>
7.1 1日あたりの総投与量はリメゲパントとして75mgを超えないこと。
<片頭痛発作の急性期治療>
7.2 本剤投与により全く効果が認められない場合は、再検査の上、頭痛の原因を確認するとともに、他の治療法を考慮すること。
<片頭痛発作の発症抑制>
7.3 本剤投与中は症状の経過を十分に観察し、本剤投与開始後3ヵ月を目安に治療上の有益性を評価して症状の改善が認められない場合には、本剤の投与中止を考慮すること。またその後も定期的に投与継続の要否について検討し、頭痛発作発現の消失・軽減等により日常生活に支障をきたさなくなった場合には、本剤の投与中止を考慮すること。
8. 重要な基本的注意
本剤は片頭痛の治療に関する十分な知識及び経験を有する医師のもとで使用すること。
9. 特定の背景を有する患者に関する注意
9.2 腎機能障害患者
9.2.1 末期腎不全の患者(eGFR 15mL/min/1.73m2未満)
投与を避けることが望ましい。本剤の非結合形の血漿中濃度が上昇し、副作用が増強されるおそれがある。末期腎不全患者を対象とした臨床試験は実施していない。
9.2.2 中等度及び重度の腎機能障害のある患者(それぞれeGFR 30〜59mL/min/1.73m2、30mL/min/1.73m2未満)
本剤の非結合形の血漿中濃度が上昇し、副作用が増強されるおそれがある。[16.6.1参照]
9.3 肝機能障害患者
9.3.1 重度の肝機能障害のある患者(Child-Pugh分類C)
投与を避けることが望ましい。本剤の非結合形の血漿中濃度が上昇し、副作用が増強されるおそれがある。[16.6.2参照]
9.3.2 中等度の肝機能障害のある患者(Child-Pugh分類B)
本剤の非結合形の血漿中濃度が上昇し、副作用が増強されるおそれがある。[16.6.2参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。ラットの胚・胎児発生試験において、器官形成期の経口投与で母体毒性がみられた用量において胎児毒性(胎児重量の低値及び骨格変異の発現頻度上昇)が認められ、胚・胎児発生に関する無毒性量の曝露量(血漿のAUC)は、ヒトに本剤75mgを1日1回投与したときの曝露量の46倍であった1)。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
授乳中健康成人女性12例にリメゲパント75mgを単回経口投与したとき、母乳及び血漿のAUC比(母乳/血漿)の平均値は0.20であり、相対的乳児投与量は1%未満であった2)(外国人データ)。
授乳中健康成人女性12例にリメゲパント75mgを単回経口投与したとき、母乳及び血漿のAUC比(母乳/血漿)の平均値は0.20であり、相対的乳児投与量は1%未満であった2)(外国人データ)。
9.7 小児等
小児等を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
10. 相互作用
相互作用序文
本剤はP-gpの基質であり、主にCYP3A4で代謝され、一部はCYP2C9で代謝される。[16.4参照]
薬物代謝酵素用語
P-gp
薬物代謝酵素用語
CYP3A4
薬物代謝酵素用語
CYP2C9
10.2 併用注意
| 強いCYP3A4阻害剤 クラリスロマイシン イトラコナゾール リトナビル等 [16.7.1参照] | 本剤の血漿中濃度が上昇し、副作用が増強されるおそれがあるため、これらの薬剤との併用を避けることが望ましい。 | これらの薬剤のCYP3A4阻害作用により、本剤の代謝が阻害され血漿中濃度が上昇する。 |
| 中程度のCYP3A4阻害剤 ジルチアゼム エリスロマイシン フルコナゾール等 [16.7.2参照] | 本剤の血漿中濃度が上昇し、副作用が増強されるおそれがある。 | これらの薬剤のCYP3A4阻害作用により、本剤の代謝が阻害され血漿中濃度が上昇する。 |
| 強い又は中程度のCYP3A4誘導剤 フェノバルビタール リファンピシン セイヨウオトギリソウ(John's Wort:セント・ジョーンズ・ワート)含有食品 ボセンタン エファビレンツ モダフィニル等 [16.7.3参照] | 本剤の血漿中濃度が低下し、作用が減弱されるおそれがあるため、これらの薬剤との併用を避けることが望ましい。 | これらの薬剤のCYP3A4誘導作用により、本剤の代謝が促進され血漿中濃度が低下する。 |
| P-gp阻害剤 シクロスポリン ベラパミル キニジン等 [16.7.4参照] | 本剤の血漿中濃度が上昇し、副作用が増強されるおそれがある。 | これらの薬剤の消化管におけるP-gp阻害作用により、本剤の消化管吸収が増大し、血漿中濃度が上昇する。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 過敏症(頻度不明)
呼吸困難や発疹等の過敏症があらわれることがある。投与から数日後に症状があらわれ、遅延型の重篤な過敏症に至ることがある。
11.2 その他の副作用
| 1%以上 | 0.5〜1%未満 | 0.5%未満 | |
| 感染症及び寄生虫症 | 上気道感染、尿路感染、単純ヘルペス、前庭神経炎 | ||
| 血液及びリンパ系障害 | 白血球減少症、好中球減少症、鉄欠乏性貧血、貧血 | ||
| 代謝及び栄養障害 | 食欲亢進 | ||
| 精神障害 | うつ病、不眠症、易刺激性、異常な夢、錯乱状態、不安 | ||
| 神経系障害 | 浮動性めまい | 傾眠、片頭痛、頭痛、錯感覚、頭部不快感、味覚不全 | |
| 眼障害 | ドライアイ | ||
| 耳及び迷路障害 | 回転性めまい | ||
| 心臓障害 | 動悸 | ||
| 血管障害 | 高血圧、潮紅 | ||
| 呼吸器、胸郭及び縦隔障害 | 呼吸困難 | ||
| 胃腸障害 | 便秘 | 悪心、下痢 | 腹痛、嘔吐、腹部不快感、胃食道逆流性疾患 |
| 肝胆道系障害 | 肝機能異常、脂肪肝 | ||
| 皮膚及び皮下組織障害 | 発疹、そう痒症、ざ瘡、多汗症、蕁麻疹 | ||
| 筋骨格系及び結合組織障害 | 頚部痛、背部痛 | ||
| 腎及び尿路障害 | 頻尿 | ||
| 一般・全身障害及び投与部位の状態 | 疲労、倦怠感、口渇 | ||
| 臨床検査 | アラニンアミノトランスフェラーゼ増加 | アスパラギン酸アミノトランスフェラーゼ増加、血中クレアチンホスホキナーゼ増加、体重増加、肝酵素上昇、血中クレアチニン増加、糸球体濾過率減少、肝機能検査値上昇、血圧上昇、心電図QT延長 | |
| 傷害、中毒及び処置合併症 | サンバーン |
13. 過量投与
13.1 処置
本剤は血清タンパク結合率が高いため、透析により有意に除去できる可能性は低い。
14. 適用上の注意
14.1 薬剤交付時の注意
患者に対し以下の点に注意するよう指導すること。
・ブリスターシートから取り出して服用すること。シートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
・ブリスターシートから取り出す際は、1錠分の裏面のシートを完全に剥がした後、錠剤を取り出すこと。本剤は通常の錠剤と比べて性質上柔らかく、割れることがあるので、裏面のシートを剥がさずに押し出さないこと。
・吸湿性を有するため、使用直前に乾いた指でブリスターシートから取り出すこと。
・本剤を水で服用した場合のデータは得られていないため、本剤は舌の上又は舌下で唾液を浸潤させた後、水なしでの服用を推奨すること。
・ブリスターシートから出したまま保管しないこと。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
日本人健康成人に、リメゲパント25mg、75mg又は150mgを単回経口投与注)したときのリメゲパントの血漿中濃度推移及び薬物動態パラメータを以下に示す3)。
リメゲパント単回投与時の血漿中濃度推移(算術平均値+標準偏差)
| 投与量 (例数) | Cmax(ng/mL) | Tmaxa)(h) | AUCinf(ng・h/mL) |
| 25mg (N=6) | 198.7 (33.0) | 1.75 (1.00,3.00) | 980.3 (19.2) |
| 75mg (N=6) | 1269 (49.3) | 1.75 (0.53,2.50) | 6297 (32.3) |
| 150mg (N=6) | 1998 (45.6) | 2.75 (1.50,4.00) | 11340 (37.8) |
16.1.2 反復投与
日本人健康成人に、リメゲパント25mg、75mg又は150mgを1日1回14日間反複経口投与注)したときのリメゲパントの薬物動態パラメータを以下に示す3)。
| 投与量 (例数) | Cmax(ng/mL) | Tmaxa)(h) | AUCtau(ng・h/mL) | T1/2b)(h) |
| 25mg (N=6) | 174.8 (40.4) | 1.52 (1.50,2.00) | 969.9 (25.9) | 8.93※ (6.56) |
| 75mg (N=6) | 953.8 (45.1) | 2.00 (1.02,4.00) | 5432 (46.4) | 10.0 (3.05) |
| 150mg (N=6) | 3000 (40.7) | 1.76 (1.50,4.00) | 16990 (35.0) | 9.05 (1.05) |
健康成人に本剤75mgを1日1回又は隔日反復経口投与したときの定常状態における薬物動態パラメータの母集団薬物動態解析に基づく推定値は以下のとおりであった4)。
| 投与方法 | Cmax(ng/mL) | AUCtaua)(ng・h/mL) |
| 75mg 1日1回反復投与 | 698 (356,1480) | 4170 (2130,8670) |
| 75mg 隔日反復投与 | 677 (335,1430) | 4160 (2080,8720) |
16.2 吸収
16.2.1 絶対バイオアベイラビリティ
健康成人8例に14C-リメゲパント300mg注)を単回経口投与したときの絶対バイオアベイラビリティは64%であった5)(外国人データ)。
16.2.2 食事の影響
健康成人15例に本剤75mgを高脂肪食摂取後に単回経口投与したとき、空腹時と比較してリメゲパントのCmaxは41%、AUCは32%低下した。また、健康成人23例に本剤75mgを低脂肪食摂取後に単回経口投与したとき、空腹時と比較してリメゲパントのCmaxは36%、AUCは28%低下した6)(外国人データ)。
16.3 分布
16.4 代謝
16.5 排泄
16.6 特定の背景を有する患者
16.6.1 腎機能障害を有する患者
軽度、中等度及び重度の腎機能障害患者(各6例)並びに腎機能正常被験者(18例)に、リメゲパント75mgを単回経口投与したとき、リメゲパントの薬物動態に及ぼす影響は下表のとおりであった11)(外国人データ)。[9.2.2参照]
| 投与対象 | 非結合形 | 総薬物 | ||
| Cmax | AUCinf | Cmax | AUCinf | |
| 軽度腎機能障害被験者 (eGFR 60〜89mL/min/1.73m2) | 1.2683 [0.7909,2.0339] | 1.2176 [0.8153,1.8184] | 1.2022 [0.7544,1.9156] | 1.0648 [0.7476,1.5167] |
| 中等度腎機能障害被験者 (eGFR 30〜59mL/min/1.73m2) | 1.1233 [0.7177,1.7581] | 1.8441 [1.3012,2.6135] | 0.7635 [0.4248,1.3725] | 1.4004 [0.9695,2.0229] |
| 重度腎機能障害被験者 (eGFR 30mL/min/1.73m2未満) | 2.1431 [1.3455,3.4135] | 2.5729 [1.8574,3.5639] | 0.8966 [0.4968,1.6183] | 1.0442 [0.6951,1.5688] |
16.6.2 肝機能障害を有する患者
軽度、中等度及び重度の肝機能障害患者(各6例)並びに肝機能正常被験者(18例)に、リメゲパント75mgを単回経口投与したとき、リメゲパントの薬物動態に及ぼす影響は下表のとおりであった12)(外国人データ)。[9.3.1、9.3.2参照]
| 投与対象 | 非結合形 | 総薬物 | ||
| Cmax | AUCinf | Cmax | AUCinf | |
| 軽度肝機能障害被験者 (Child-Pugh 分類A) | 1.1945 [0.7662,1.8621] | 1.0817 [0.7358,1.5902] | 0.9228 [0.6415,1.3274] | 0.8357 [0.5825,1.1990] |
| 中等度肝機能障害被験者 (Child-Pugh 分類B) | 1.3261 [0.7070,2.4871] | 1.6475 [1.0434,2.6014] | 0.8621 [0.4529,1.6412] | 1.0711 [0.6931,1.6550] |
| 重度肝機能障害被験者 (Child-Pugh 分類C) | 3.6355 [2.0036,6.5964] | 3.8867 [2.2485,6.7184] | 1.8914 [1.3211,2.7080] | 2.0221 [1.5420,2.6517] |
16.7 薬物相互作用
16.7.1 イトラコナゾール
16.7.2 フルコナゾール
16.7.3 リファンピシン
16.7.4 キニジン及びシクロスポリン
16.7.5 経口避妊薬
健康成人女性20例にリメゲパント75mg及び経口避妊薬(エチニルエストラジオール35ng及びノルゲスチメート250ngを含む)を併用したとき、経口避妊薬単独投与と比較して、エチニルエストラジオールのCmax及びAUCはそれぞれ1.34倍及び1.20倍、ノルゲストロミンのCmax及びAUCはそれぞれ1.40倍及び1.46倍であった15)(外国人データ)。
16.7.6 スマトリプタン
健康成人42例にリメゲパント75mg及びスマトリプタン(1時間間隔で6mgを2回皮下投与)を併用したとき、リメゲパント単独投与と比較して、リメゲパントのCmax及びAUCはそれぞれ1.22倍及び1.26倍であった。スマトリプタン単独と比較して、スマトリプタンのCmax及びAUCは、それぞれ1.09倍及び1.05倍であった。安静時の血圧に対する影響は認められなかった16)(外国人データ)。
注)本剤の承認用量は75mgである。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<片頭痛発作の急性期治療>
17.1.1 国内第II/III相試験(C4951022試験/BHV3000-313試験)
18歳以上の片頭痛患者(スクリーニング来院前3ヵ月間の中等度又は重度の片頭痛発作回数が2回/月以上かつ頭痛日数が15日/月未満)を対象に、片頭痛発作の急性期治療に係る本剤の有効性を評価するプラセボ対照無作為化二重盲検比較試験を実施した17)。
中等度又は重度の片頭痛発現時に本剤75mg(238例)又はプラセボ(229例)を単回経口投与した。主要評価項目である投与2時間後の頭痛消失において本剤75mgのプラセボに対する優越性が示された。
中等度又は重度の片頭痛発現時に本剤75mg(238例)又はプラセボ(229例)を単回経口投与した。主要評価項目である投与2時間後の頭痛消失において本剤75mgのプラセボに対する優越性が示された。
| 本剤75mg群 (238例)a) | プラセボ群 (230例)a) | |
| 投与2時間後の頭痛消失(%) | 32.4 (77/238) | 13.0 (30/230) |
| プラセボ群に対する差(95%信頼区間)b) | 19.4 (12.0,26.8) | |
| p値 | <0.0001 |
副作用発現割合は2.5%(6/238)であり、本剤75mg群で1%以上に認められた副作用はなかった。
17.1.2 海外第III相試験(BHV3000-303試験)
18歳以上の片頭痛患者(スクリーニング来院前3ヵ月間の中等度又は重度の片頭痛発作回数が2回/月以上かつ頭痛日数が15日/月未満)を対象に、片頭痛発作の急性期治療に係る本剤の有効性を評価するプラセボ対照無作為化二重盲検比較試験を実施した18)。
中等度又は重度の片頭痛発現時に本剤75mg(682例)又はプラセボ(693例)を単回経口投与した。主要評価項目である投与2時間後の頭痛消失及び片頭痛に関連する最も煩わしい症状(MBS)消失において本剤のプラセボに対する優越性が示された。
中等度又は重度の片頭痛発現時に本剤75mg(682例)又はプラセボ(693例)を単回経口投与した。主要評価項目である投与2時間後の頭痛消失及び片頭痛に関連する最も煩わしい症状(MBS)消失において本剤のプラセボに対する優越性が示された。
| 本剤75mg群 (669例)a) | プラセボ群 (682例)a) | ||
| 投与2時間後の頭痛消失 | 達成割合(%) | 21.2 (142/669) | 10.9 (74/682) |
| 差(%) (95%信頼区間)b) | 10.37 (6.5,14.2) | ||
| p値c) | <0.0001 | ||
| 投与2時間後のMBS消失 | 達成割合(%) | 35.1 (235/669) | 26.8 (183/682) |
| 差(%) (95%信頼区間)b) | 8.29 (3.4,13.2) | ||
| p値c) | 0.0009 | ||
副作用発現割合は6.9%(47/682)であり、主な副作用は悪心(1.3%)であった。
<片頭痛発作の発症抑制>
17.1.3 国内第III相試験(C4951021試験/BHV3000-309試験)
18歳以上の片頭痛患者[観察期間(28日間)中の片頭痛日数が4日以上かつ頭痛日数が18日以下]を対象に、片頭痛発作の発症抑制に係る本剤の有効性を評価するプラセボ対照無作為化二重盲検比較試験を実施した19)。
二重盲検期(12週間)に本剤75mg(247例)又はプラセボ(249例)を隔日で経口投与した。主要評価項目である二重盲検期の最後の4週間における1ヵ月あたりの平均片頭痛日数の観察期間からの変化量において、本剤のプラセボに対する優越性が示された。
二重盲検期(12週間)に本剤75mg(247例)又はプラセボ(249例)を隔日で経口投与した。主要評価項目である二重盲検期の最後の4週間における1ヵ月あたりの平均片頭痛日数の観察期間からの変化量において、本剤のプラセボに対する優越性が示された。
| 本剤75mg群 (240例)a) | プラセボ群 (244例)a) | 群間差 | |
| 観察期間の平均片頭痛日数(標準偏差) | 9.26(3.084) | 9.04(3.142) | |
| 1ヵ月あたりの平均片頭痛日数の観察期間からの変化量(最小二乗平均) (95%信頼区間)b) | −2.4 (−2.93,−1.96) | −1.4 (−1.87,−0.91) | −1.1 (−1.73,−0.38) |
| p値 | 0.0021 |
二重盲検期の副作用発現割合は9.7%(24/247)であり、主な副作用は便秘(1.6%)であった。
17.1.4 海外第II/III相試験(BHV3000-305試験)
18歳以上の片頭痛患者[観察期間(28日間)中の片頭痛日数が6日以上かつ頭痛日数が18日以下]を対象に、片頭痛発作の発症抑制に係るリメゲパント75mg注)の有効性を評価するプラセボ対照無作為化二重盲検比較試験を実施した20)。
二重盲検期(12週間)にリメゲパント75mg(370例)又はプラセボ(371例)を隔日で経口投与した。主要評価項目である二重盲検期の最後の4週間における1ヵ月あたりの平均片頭痛日数の観察期間からの変化量において、リメゲパントのプラセボに対する優越性が示された。
二重盲検期(12週間)にリメゲパント75mg(370例)又はプラセボ(371例)を隔日で経口投与した。主要評価項目である二重盲検期の最後の4週間における1ヵ月あたりの平均片頭痛日数の観察期間からの変化量において、リメゲパントのプラセボに対する優越性が示された。
| リメゲパント75mg群 (348例)a) | プラセボ群 (347例)a) | 群間差 | |
| 観察期間の平均片頭痛日数(標準偏差) | 10.3(3.18) | 9.9(2.98) | |
| 1ヵ月あたりの平均片頭痛日数の観察期間からの変化量(最小二乗平均) (95%信頼区間)b) | −4.3 (−4.83,−3.87) | −3.5 (−4.00,−3.04) | −0.8 (−1.46,−0.20) |
| p値 | 0.0099 |
二重盲検期の副作用発現割合は10.8%(40/370)であり、主な副作用は悪心(1.4%)及びうつ病(1.1%)であった。
注)普通錠を用いて実施された。
18. 薬効薬理
18.1 作用機序
リメゲパントは経口投与可能なカルシトニン遺伝子関連ペプチド(CGRP)受容体拮抗剤であり、片頭痛の病態生理に関与すると考えられるCGRPの作用を抑制する。
18.2 CGRP受容体拮抗作用
リメゲパントはヒトCGRP受容体に対するヒトCGRPの結合を濃度依存的に阻害し、そのKi値は32.9pmol/Lであった(in vitro)21)。
18.3 細胞におけるCGRP機能の阻害作用
リメゲパントはヒト神経芽細胞腫(SK-N-MC細胞)においてヒトCGRP刺激によるcAMP産生を濃度依存的に阻害し、そのIC50値は140.8pmol/Lであった(in vitro)21)。
18.4 マーモセットにおけるCGRP受容体拮抗作用
リメゲパントはマーモセットへの単回皮下投与により、ヒトCGRP刺激による顔面血流量の増加を用量依存的に阻害した(in vivo)21)。
19. 有効成分に関する理化学的知見
19.1. リメゲパント硫酸塩水和物
21. 承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
7錠[7錠(ブリスター)×1]
14錠[7錠(ブリスター)×2]
23. 主要文献
- 生殖発生毒性試験(2025年9月19日承認、CTD2.6.6.6)
- Baker TE,et al., Breastfeed Med., 17 (3), 277-282, (2022) »PubMed
- 日本人及び白人健康成人での反復投与試験(2025年9月19日承認、CTD2.7.6.13)
- 薬物動態プロファイル(2025年9月19日承認、CTD2.7.2.3.1)
- マスバランス試験(2025年9月19日承認、CTD2.7.6.8)
- 食事の影響評価試験(2025年9月19日承認、CTD2.7.6.1、CTD2.7.6.5)
- 母集団薬物動態解析結果(2025年9月19日承認、CTD2.7.2.5.Appendix3.1)
- ヒトタンパク結合率解析結果(2025年9月19日承認、CTD2.7.2.2.1.1)
- In vitro代謝試験(2025年9月19日承認、CTD2.6.5.10-C)
- In vivo代謝試験(2025年9月19日承認、CTD2.6.4.5.2)
- 腎機能障害の影響評価試験(2025年9月19日承認、CTD2.7.6.10)
- Bhardwaj R,et al., Clin Pharmacol Drug Dev., 12 (8), 790-800, (2023) »PubMed
- Bhardwaj R,et al., Headache., 65, 291-302, (2025) »PubMed
- Bhardwaj R,et al., Clin Pharmacol Drug Dev., 11 (7), 889-897, (2022) »PubMed
- Bhardwaj R,et al., Headache., 63, 652-662, (2023) »PubMed
- Croop R,et al., Cephalalgia Reports., 4, 1-10, (2021)
- 国内第II/III相試験(C4951022試験/BHV3000-313試験)(2025年9月19日承認、CTD2.7.6.31)
- 海外第III相試験(BHV3000-303試験)(2025年9月19日承認、CTD2.7.6.28)
- 国内第III相試験(C4951021試験/BHV3000-309試験)(2025年9月19日承認、CTD2.7.6.36)
- 海外第II/III相試験(BHV3000-305試験)(2025年9月19日承認、CTD2.7.6.35)
- 効力を裏付ける試験(2025年9月19日承認、CTD2.6.2.2)
24. 文献請求先及び問い合わせ先
文献請求先
ファイザー株式会社
Pfizer Connect/メディカル・インフォメーション
〒151-8589
東京都渋谷区代々木3-22-7
電話:0120-664-467
製品情報問い合わせ先
ファイザー株式会社
Pfizer Connect/メディカル・インフォメーション
〒151-8589
東京都渋谷区代々木3-22-7
電話:0120-664-467
26. 製造販売業者等
26.1 製造販売元
ファイザー株式会社
東京都渋谷区代々木3-22-7