医薬品情報
| 総称名 | フジケノン |
|---|---|
| 一般名 | ケノデオキシコール酸 |
| 欧文一般名 | Chenodeoxycholic Acid |
| 製剤名 | ケノデオキシコール酸粒状錠 |
| 薬効分類名 | 脳腱黄色腫症治療剤 |
| 薬効分類番号 | 3999 |
| KEGG DRUG |
D00163
ケノデオキシコール酸
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年9月 作成(第1版)

|
2.禁忌 4.効能または効果 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 21.承認条件 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 25.保険給付上の注意 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| フジケノン粒状錠125 | FUJICHENON GRANULAR TABLETS | 藤本製薬 | 3999066F1020 | 22043円/包 |
2. 禁忌
次の患者には投与しないこと
2.1 胆道閉塞のある患者[9.3.2参照]
2.2 本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
脳腱黄色腫症
6. 用法及び用量
通常、成人にはケノデオキシコール酸として1日量250mgより投与開始し、250mgずつ増量した後、維持量として1日量750mgを、1日3回に分けて連日経口投与する。なお、患者の状態により適宜増減するが、1日量として1000mgを超えないこと。また、1回あたりの投与量として375mgを超えないこと。
通常、小児にはケノデオキシコール酸として1日量5mg/kgより投与開始し、5mg/kgずつ増量した後、維持量として1日量15mg/kgを、1日3回に分けて連日経口投与する。なお、患者の状態により適宜増減するが、1日量として15mg/kg及び750mgのいずれも超えないこと。また、1回あたりの投与量として250mgを超えないこと。
7. 用法及び用量に関連する注意
7.1 本剤の維持量への漸増は2週間毎を目安に行うこと。
7.2 小児に対する漸増時の本剤の投与量について、1日投与量を5mg/kgとする場合は250mgを、10mg/kgとする場合は500mgを、15mg/kgとする場合は750mgを超えないこと。
8. 重要な基本的注意
肝機能障害があらわれることがあるので、定期的に肝機能検査を行うこと。また、重度の肝機能障害が認められた場合は、本剤の投与を中止すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 家族性IV型高脂血症を有する患者
本剤の吸収が低下するおそれがある。回腸末端部に発現する胆汁酸トランスポーター(IBAT)の発現が低下しているとの報告があり1)、胆汁酸の取り込みが低下しているおそれがある。
9.3 肝機能障害患者
9.3.1 重篤な肝障害のある患者
肝機能や患者の状態を観察しながら慎重に投与すること。代謝物により、肝障害を悪化させるおそれがある。
9.3.2 胆道閉塞のある患者
投与しないこと。利胆作用により、胆汁うっ滞が増悪するおそれがある。[2.1参照]
9.3.3 胆道系に閉塞をきたすおそれのある病変を有する患者、胆管に結石のある患者
肝機能や患者の状態を観察しながら慎重に投与すること。利胆作用により、胆汁うっ滞を惹起するおそれがある。
9.5 妊婦
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。ラットにおいて、乳汁移行が認められている4)。
9.7 小児等
小児等を対象とした臨床試験成績は得られていない。
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。一般に生理機能が低下していることが多い。
10. 相互作用
10.2 併用注意
| 制酸作用を有するアルミニウム含有製剤 水酸化アルミニウムゲル等 | 本剤の作用が減弱されるおそれがあるため、可能な限り間隔をあけて投与すること。 | アルミニウムを含有する制酸剤は本剤を吸着し、本剤の吸収が阻害されるおそれがある。 |
| 陰イオン交換樹脂 コレスチラミン コレスチミド | 本剤の作用が減弱されるおそれがあるため、可能な限り間隔をあけて投与すること。 | 本剤と結合し吸収が阻害されるおそれがある。 |
| ウルソデオキシコール酸 | 本剤及びウルソデオキシコール酸の作用が減弱するおそれがあるため、可能な限り間隔をあけて投与すること。 | 本剤及びウルソデオキシコール酸の吸収が競合するおそれがある。 |
| IBAT阻害剤 エロビキシバット | 本剤の作用が減弱されるおそれがある。 | 本剤のIBATを介した再吸収が阻害されるおそれがある。 |
| シクロスポリン シロリムス | 本剤の作用が減弱されるおそれがある。 | 本剤によるコレスタノール蓄積抑制作用に拮抗することで、本剤の治療効果を減弱させるおそれがある。 |
| フェノバルビタール プリミドン | 本剤の作用が減弱されるおそれがある。 | 本剤によるコレスタノール蓄積抑制作用に拮抗することで、本剤の治療効果を減弱させるおそれがある。 |
| 経口避妊薬 | 本剤の作用が減弱されるおそれがある。 | 本剤のプールサイズを減少させるおそれがある。 |
11. 副作用
11.2 その他の副作用
| 5%以上 | 頻度不明 | |
| 肝臓 | 肝機能異常 | ALT、AST、ALP、ビリルビンの上昇等 |
| 消化器 | 鼓腸 | 下痢、軟便、悪心、嘔吐、食欲不振、腹痛、胸やけ、腹部不快感、腹部膨満感 |
| 過敏症 | 発疹、そう痒 | |
| その他 | 倦怠感、めまい、顔のむくみ |
16. 薬物動態
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験
脳腱黄色腫症患者15例を対象に、本剤を52週間経口投与する非盲検非対照試験を実施した。成人の用法・用量は、未治療例では250mg/日より開始し、2週間毎に250mg/日ずつ漸増し、750mg/日で投与を継続した。既治療例では本剤以外のケノデオキシコール酸製剤と同量で開始し、2週間毎に750mg/日まで漸増し、750mg/日で投与を継続した。未治療例、既治療例共に最大1000mg/日まで増量可とした。小児の用法・用量は、未治療例では5mg/kg/日より開始し、2週間毎に5mg/kg/日ずつ漸増し、15mg/kg/日(最大750mg/日)で投与を継続した。既治療例では本剤以外のケノデオキシコール酸製剤と同量で開始し、2週間毎に15mg/kg/日まで漸増し、15mg/kg/日(最大750mg/日)で投与を継続した。
組み入れられた15例全例(未治療例3例、既治療例12例)が成人患者であり、小児患者は組み入れられなかった。主要評価項目である血清コレスタノール濃度(μg/mL(平均値±標準偏差))は、各患者の脳腱黄色腫症の診断時は22.25±12.66、ベースライン時は8.66±7.70、投与52週時は6.73±5.67であった。副作用発現頻度は20.0%(3/15例)であり、認められた副作用は肝機能異常(2例)及び鼓腸(1例)であった9)。
組み入れられた15例全例(未治療例3例、既治療例12例)が成人患者であり、小児患者は組み入れられなかった。主要評価項目である血清コレスタノール濃度(μg/mL(平均値±標準偏差))は、各患者の脳腱黄色腫症の診断時は22.25±12.66、ベースライン時は8.66±7.70、投与52週時は6.73±5.67であった。副作用発現頻度は20.0%(3/15例)であり、認められた副作用は肝機能異常(2例)及び鼓腸(1例)であった9)。
18. 薬効薬理
18.1 作用機序
脳腱黄色腫症の患者では、遺伝子変異によるCYP27A1の活性低下により、コレステロールから胆汁酸への代謝が進まず、ケノデオキシコール酸の中間代謝物から生じるコレスタノールが過剰に産生・蓄積されることで、様々な臓器障害が生じる。また、ケノデオキシコール酸の減少により、胆汁酸合成時の律速酵素であるCYP7A1に対する負のフィードバック機構が機能せず、コレスタノールの産生が亢進する。本剤は、ファルネソイドX受容体の活性化を介してCYP7A1に対する負のフィードバック機構を正常化させ、脳腱黄色腫症におけるコレスタノールの産生・蓄積を抑制すると考えられる。
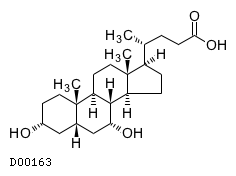
19. 有効成分に関する理化学的知見
19.1. ケノデオキシコール酸
21. 承認条件
21.1 医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
12包(スティック包装)[6包×2]
60包(スティック包装)[6包×10]
23. 主要文献
- Duane WC,et al., J Lipid Res., 41, 1384-1389, (2000) »PubMed
- Yahalom G,et al., Clin Neuropharmacol., 36, 78-83, (2013) »PubMed
- Palmer AK,et al., Toxicology., 2, 239-246, (1974) »PubMed
- 太田 正道 他, 応用薬理, 15, 583-595, (1978)
- 滝川 一, 胆道, 25, 189-195, (2011) »DOI
- 内田清久, ビフィズス, 5, 157-172, (1992) »DOI
- Roda A,et al., J Lipid Res., 23, 490-495, (1982) »PubMed
- Danzinger RC,et al., J Clin Invest., 52, 2809-2821, (1973) »PubMed
- 社内資料:FPF1011-03-01試験(国内第III相試験)(2025年9月19日承認、CTD2.7.6.1)
24. 文献請求先及び問い合わせ先
文献請求先
藤本製薬株式会社
学術部
〒580-8503
大阪府松原市西大塚1丁目3番40号
電話:0120-225-591
FAX:0120-116-026
製品情報問い合わせ先
藤本製薬株式会社
学術部
〒580-8503
大阪府松原市西大塚1丁目3番40号
電話:0120-225-591
FAX:0120-116-026
25. 保険給付上の注意
本剤は新医薬品であるため、厚生労働省告示に基づき、2026年11月末日までは、投薬は1回14日分を限度とされている。
26. 製造販売業者等
26.1 製造販売元
藤本製薬株式会社
〒580-8503
大阪府松原市西大塚1丁目3番40号