医薬品情報
| 総称名 | セピエンス |
|---|---|
| 一般名 | セピアプテリン |
| 欧文一般名 | Sepiapterin |
| 製剤名 | セピアプテリン製剤 |
| 薬効分類名 | フェニルケトン尿症治療剤 |
| 薬効分類番号 | 3999 |
| KEGG DRUG |
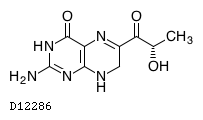
D12286
セピアプテリン
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年12月 作成(第1版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| セピエンス顆粒分包250mg | SEPHIENCE GRANULES | PTCセラピューティクス | 39990F4D1020 | 処方箋医薬品注) | |
| セピエンス顆粒分包1000mg | SEPHIENCE GRANULES | PTCセラピューティクス | 39990F4D2027 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
5. 効能または効果に関連する注意
BH4欠損症に対する本剤の有効性及び安全性は確立していない。
6. 用法及び用量
通常、セピアプテリンとして、以下の用量を1日1回食後又は食事とともに経口投与する。なお、忍容性が認められない場合、6カ月以上2歳未満では1日7.5mg/kgまで、2歳以上では1日20mg/kgまでの範囲で適宜減量すること。
| 年齢 | 1日量 |
| 0カ月以上6カ月未満 | 7.5mg/kg |
| 6カ月以上1歳未満 | 15mg/kg |
| 1歳以上2歳未満 | 30mg/kg |
| 2歳以上 | 60mg/kg |
7. 用法及び用量に関連する注意
8. 重要な基本的注意
8.1 定期的に血中フェニルアラニン濃度を測定し、血中フェニルアラニン濃度を適切に管理すること。
8.2 本剤投与により低フェニルアラニン血症に至るおそれがあるため、血中フェニルアラニン濃度が管理目標の範囲を下回る場合は、食事からのタンパク摂取量を増加させ、必要に応じて本剤の減量又は投与中断も検討すること。[9.1.1参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 食事摂取不良等により栄養状態が不良の患者
低フェニルアラニン血症の発現に注意すること。[8.2参照]
9.1.2 サプロプテリン塩酸塩に対し過敏症の既往歴のある患者
過敏症の発現に注意すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。本剤のヒト母乳中への移行は不明であるが、サプロプテリンを用いた動物実験において、テトラヒドロビオプテリン(BH4)は乳汁中へ移行することが報告されている。
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。一般に生理機能が低下していることが多い。
10. 相互作用
10.2 併用注意
| ジヒドロ葉酸還元酵素阻害薬 メトトレキサート プララトレキサート ペメトレキセド等 | 本剤の有効性が減弱する可能性があるため、血中フェニルアラニン濃度を確認し、必要に応じて食事からのタンパク摂取量を調節すること。 | これらの薬剤がジヒドロ葉酸還元酵素を阻害するため、ジヒドロビオプテリン(BH2)のBH4への代謝が阻害される可能性がある。 |
| サラゾスルファピリジン スルファメトキサゾール含有製剤 | 本剤の有効性が減弱する可能性があるため、血中フェニルアラニン濃度を確認し、必要に応じて食事からのタンパク摂取量を調節すること。 | これらの薬剤がセピアプテリン還元酵素を阻害するため、本剤のBH2への代謝が阻害されることで、BH4の生成が阻害される可能性がある。 |
| レボドパ含有製剤 | 興奮性、易刺激性が生じることがあるので、このような症状が認められた場合には、本剤の減量を検討するなど慎重に投与すること。 | 併用により相加的にカテコールアミンの産生が増加する可能性がある。 |
| 硝酸剤及びNO供与剤 ニトログリセリン 硝酸イソソルビド等 PDE5阻害剤 シルデナフィルクエン酸塩 タダラフィル等 | これらの薬剤の血圧低下作用が増強される可能性があるため、血圧等の患者の状態を観察しながら慎重に投与すること。 | BH4は一酸化窒素合成酵素の補酵素として機能するため、併用により一酸化窒素を介した血管弛緩作用を増強させる可能性がある。 |
11. 副作用
11.2 その他の副作用
| 5〜10%未満 | 1〜5%未満 | |
| 消化器 | 下痢、変色便 | 嘔吐、悪心、上腹部痛、便秘、腹痛、鼓腸、腹部不快感、腹部膨満、消化不良、軟便 |
| 中枢神経系 | 頭痛 | 浮動性めまい |
| 一般・全身障害および投与部位の状態 | 疲労 | |
| 精神障害 | 不安 | |
| 皮膚および皮下組織障害 | 斑状丘疹状皮疹 | |
| 腎および尿路障害 | 着色尿 | |
| 代謝および栄養障害 | 食欲減退 | |
| 臨床検査 | 血中フェニルアラニン濃度低値注) |
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 本剤は再分包せず、分包品のまま交付すること。
14.1.2 患者に以下の服用方法を説明すること。
・本剤は顆粒のまま服用せず、水若しくはリンゴジュース又は柔らかい食べ物(リンゴソース又はイチゴジャム)に混ぜて服用すること。
・体重16kg以下の患者は、本剤250mg分包を使用する場合は1包あたり9mL、1000mg分包を使用する場合は1包あたり36mLの水又はリンゴジュースを本剤に加えて均一に混ぜ、指示された量を経口投与用シリンジで量り取り、服用すること。
・体重16kgを超える患者は、本剤250mg分包を使用する場合は1包あたり10mL、1000mg分包を使用する場合は1包あたり20mLの水又はリンゴジュースを本剤に加えて混ぜ、服用すること。水又はリンゴジュースの代わりに、服用する全量を大さじ2杯分の柔らかい食べ物(リンゴソース又はイチゴジャム)に混ぜて、服用することもできる。
・本剤を水などと混合した後は、25℃以下で保存した場合は6時間以内、冷蔵(2〜8℃)で保存した場合は24時間以内に服用すること。保存後に服用する場合は、再度混合してから服用すること。
・混合後の残薬は廃棄すること。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
(1)健康成人
日本人健康成人に本剤20、40、60mg/kgを食後に単回投与したときのセピアプテリン及びBH4の薬物動態パラメータは以下のとおりであった1)。また、外国人健康成人3例にサプロプテリン20mg/kgを単回投与したときのBH4のCmax(幾何平均値)は80.29ng/mL、AUClast(幾何平均値)は603.7ng・h/mL、tmax(中央値)は2.0時間、消失半減期(幾何平均値)は5.3時間であった2)。
| 用量 (mg/kg) | 例数 | Cmax (ng/mL) | AUClast (ng・h/mL) | tmax (h) | t1/2 (h) |
| セピアプテリン | |||||
| 20 | 6 | 2.33 (29.2) | 11.1 (39.3) | 4.50 [3.00,5.00] | − |
| 40 | 6 | 3.33 (11.4)a) | 15.3 (34.3)a) | 3.02 [2.02,5.02]a) | − |
| 60 | 6 | 4.66 (33.8) | 22.8 (53.0) | 4.00 [2.00,5.00] | 3.46b) |
| BH4 | |||||
| 20 | 6 | 476 (20.8) | 2920 (19.2) | 5.00 [4.00,5.00] | 6.31 (12.2)c) |
| 40 | 6 | 552 (27.5)a) | 3420 (23.1)a) | 5.00 [4.05,5.02]a) | 6.79 (20.8)d) |
| 60 | 6 | 511 (11.7) | 3280 (7.2) | 4.00 [3.00,5.00] | 6.66 (21.8)a) |
(2)フェニルケトン尿症患者
フェニルケトン尿症患者に本剤を経口投与したときの国際共同第III相試験の投与1日目におけるセピアプテリン及びBH4の薬物動態パラメータは以下のとおりであった3)。
| 用量 (mg/kg) | 年齢 | 例数 | Cmax (ng/mL) | AUC0-24h (ng・h/mL) |
| セピアプテリン | ||||
| 7.5 | 6カ月未満 | 1 | 1.21 | − |
| 30 | 1〜2歳未満 | 5 | 3.33,13.6b) | − |
| 60 | 2〜6歳未満 | 7 | 1.54(17.2)c) | 2.81,9.25b) |
| 6〜12歳未満 | 4 | 2.57(103) | 10.9(221) | |
| 12〜18歳未満 | 7 | 2.64(74.4)d) | 12.1(78.1)d) | |
| 18歳以上 | 20 | 2.31(47.2)e) | 12.9(81.2)f) | |
| BH4 | ||||
| 7.5 | 6カ月未満 | 1 | 207 | − |
| 15 | 6〜12カ月未満 | 1 | 248 | 2410 |
| 30 | 1〜2歳未満 | 5 | 194(40.1) | 1710(34.6)g) |
| 60 | 2〜6歳未満 | 6 | 270(59.0)h) | 2580(54.3)h) |
| 6〜12歳未満 | 4 | 392(49.1) | 3430(43.8) | |
| 12〜18歳未満 | 7 | 298(88.2)d) | 2260(116)d) | |
| 18歳以上 | 20 | 436(40.4) | 3520(44.2) | |
16.1.2 反復投与
外国人健康成人に本剤60mg/kgを1日1回高脂肪食と7日間反復経口投与したときのセピアプテリン及びBH4の薬物動態パラメータは以下のとおりであった2)。
| 評価時点 | 例数 | Cmax (ng/mL) | AUCa) (ng・h/mL) | tmax (h) | t1/2 (h) |
| セピアプテリン | |||||
| 1日目 | 6 | 2.50 (41) | 20.32 (32.8) | 4.00 [2.00,4.00] | 17.40b) |
| 7日目 | 6 | 2.72 (27) | 15.20 (38.0) | 3.00 [1.98,4.00] | 3.90b) |
| BH4 | |||||
| 1日目 | 6 | 577.90 (29.4) | 4538 (27.1)c) | 4.00 [4.00,8.03] | 3.76 (16) |
| 7日目 | 6 | 646.06 (35.8) | 4518 (45.8) | 4.00 [3.98,4.03] | 3.38 (13) |
16.2 吸収
16.2.1 食事の影響
外国人健康成人14例に本剤60mg/kgを空腹時及び高脂肪食摂取後に単回経口投与したとき、セピアプテリンのCmax及びAUC0-24hの幾何平均値の比(高脂肪食摂取時/空腹時)は1.10及び1.97、BH4のCmax及びAUC0-24hの幾何平均値の比(高脂肪食摂取時/空腹時)は2.21及び2.84であった4)。
16.3 分布
16.4 代謝
16.5 排泄
外国人健康成人8例に本剤の14C標識体4000mg注)を経口投与したとき、投与後240時間までの尿中及び糞中放射能の累積排泄率(平均値)は投与放射能の6.71%及び26.2%であった9)。
16.7 薬物相互作用
外国人健康成人29例に本剤20mg/kgとクルクミン(BCRP阻害薬)2gを単回併用投与したとき、セピアプテリン及びBH4のCmax及びAUClastの幾何平均値の比(併用投与時/単独投与時)は、セピアプテリンでは1.14及び1.36、BH4では1.24及び1.20であった。また、本剤60mg/kgとロスバスタチン(BCRP基質)10mgを単回併用投与したとき、ロスバスタチンのCmax及びAUClastの幾何平均値の比(併用投与時/単独投与時)は1.13及び1.02であった10)。
注)本剤の承認用量は、2歳以上では1日1回60mg/kgである。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 海外第III相試験11)
フェニルケトン尿症患者157例(1〜61歳)を対象として、パート1では、本剤7.5mg/kg(6カ月未満)、15mg/kg(6カ月以上1歳未満)、30mg/kg(1歳以上2歳未満)又は60mg/kg(2歳以上)を非盲検下で1日1回14日間、食後または食事とともに経口投与した。本剤投与後の血中フェニルアラニン濃度(投与5、10及び14日目の平均値)のベースライン(パート1の本剤投与開始前日及び開始日の平均値)からの低下率が15%以上の患者の割合は73.1%(114/156例)であった。
本剤投与後の血中フェニルアラニン濃度のベースラインからの低下率が15%以上であった2歳以上の患者がパート2に移行し、本剤又はプラセボを二重盲検下で1日1回6週間(本剤の用量は投与開始後1、2週は20mg/kg、3、4週は40mg/kg、5、6週は60mg/kg)、食後または食事とともに経口投与した(プラセボ群:54例、本剤群:56例)。パート2に移行した治験参加者のうち、パート1で本剤投与後の血中フェニルアラニン濃度のベースラインからの低下率が30%以上であった患者(プラセボ群:49例、本剤群:49例)を有効性の主要解析対象集団とした。当該集団における主要評価項目であるパート2の平均血中フェニルアラニン濃度のベースラインからの変化量は表4のとおりであり、本剤のプラセボに対する優越性が検証された。
本剤投与後の血中フェニルアラニン濃度のベースラインからの低下率が15%以上であった2歳以上の患者がパート2に移行し、本剤又はプラセボを二重盲検下で1日1回6週間(本剤の用量は投与開始後1、2週は20mg/kg、3、4週は40mg/kg、5、6週は60mg/kg)、食後または食事とともに経口投与した(プラセボ群:54例、本剤群:56例)。パート2に移行した治験参加者のうち、パート1で本剤投与後の血中フェニルアラニン濃度のベースラインからの低下率が30%以上であった患者(プラセボ群:49例、本剤群:49例)を有効性の主要解析対象集団とした。当該集団における主要評価項目であるパート2の平均血中フェニルアラニン濃度のベースラインからの変化量は表4のとおりであり、本剤のプラセボに対する優越性が検証された。
| プラセボ群 (49例) | 本剤群 (49例) | |
| ベースラインa) | 654.04±261.54 | 646.11±253.01 |
| 投与5週時及び投与6週時の平均値 | 637.85±259.89 | 236.04±174.94 |
| ベースラインからの変化量 | −16.19±198.64 | −410.07±204.44 |
| プラセボ群との群間差b) | −395.87[−463.07,−328.66] | |
| p値b) | p<0.0001 | |
また、主要解析対象集団における各用量での血中フェニルアラニン濃度のベースラインからの変化量(平均値±標準偏差)は、本剤20mg/kg投与時(投与1週時及び投与2週時の平均値)で−341.18±226.18μmol/L、本剤40mg/kg投与時(投与3週時及び投与4週時の平均値)で−406.88±199.26μmol/Lであった。
パート1における副作用の発現割合は17.8%(28/157例)であり、主な副作用は下痢3.8%(6/157例)、変色便2.5%(4/157例)、嘔吐1.9%(3/157例)、上腹部痛1.9%(3/157例)、悪心1.9%(3/157例)であった。
パート2における副作用の発現割合はプラセボ群で11.1%(6/54例)、本剤群で10.7%(6/56例)であり、本剤群における主な副作用は変色便3.6%(2/56例)であった。[7.参照]
パート1における副作用の発現割合は17.8%(28/157例)であり、主な副作用は下痢3.8%(6/157例)、変色便2.5%(4/157例)、嘔吐1.9%(3/157例)、上腹部痛1.9%(3/157例)、悪心1.9%(3/157例)であった。
パート2における副作用の発現割合はプラセボ群で11.1%(6/54例)、本剤群で10.7%(6/56例)であり、本剤群における主な副作用は変色便3.6%(2/56例)であった。[7.参照]
17.1.2 国際共同第III相試験3)
海外第III相試験から移行したフェニルケトン尿症患者、及び本試験から参加したフェニルケトン尿症患者の合計223例(0.2〜55歳)に、本剤7.5mg/kg(6カ月未満)、15mg/kg(6カ月以上1歳未満)、30mg/kg(1歳以上2歳未満)又は60mg/kg(2歳以上)を非盲検下で1日1回、食後または食事とともに経口投与した。本剤に対する反応性を確認する期間において、本剤投与により血中フェニルアラニン濃度が360μmol/L未満となった患者を有効性の主要解析対象集団とし、血中フェニルアラニン濃度に応じ、食事からのフェニルアラニン摂取量を調節(300μmol/L未満の場合は増量)した。主要評価項目であるベースラインから投与26週時までの食事性フェニルアラニン摂取量の変化量及び血中フェニルアラニン濃度の変化量は表5のとおりであった。
| 食事性フェニルアラニン摂取量 (mg/kg/日) | 血中フェニルアラニン濃度 (μmol/L) | |
| ベースラインa) | 28.52±18.17 (117例) | 186.94±74.21 (117例) |
| 投与26週時 | 63.49±40.57 (93例) | 355.51±234.76 (92例) |
| ベースラインからの変化量 | 36.85±36.91 | 170.63±235.20 |
| 変化量の最小二乗平均 [95%信頼区間] | 36.84 [31.64,42.04]b) | − |
2025年2月4日のデータカットオフ時点での副作用の発現割合は26.9%(60/223例)であり、主な副作用は下痢7.2%(16/223例)、変色便7.2%(16/223例)、頭痛6.7%(15/223例)、嘔吐2.2%(5/223例)、便秘2.2%(5/223例)、倦怠感2.2%(5/223例)であった。[7.参照]
18. 薬効薬理
18.1 作用機序
セピアプテリンは、BH4の内因性前駆体である。
セピアプテリンは、細胞内でBH4に変換され、フェニルアラニン水酸化酵素の補酵素として作用する。また、セピアプテリン及びBH4は、フェニルアラニン水酸化酵素の薬理学的シャペロンとしても作用し、フェニルアラニン水酸化酵素の安定性を増加させる可能性がある。
セピアプテリンは、細胞内でBH4に変換され、フェニルアラニン水酸化酵素の補酵素として作用する。また、セピアプテリン及びBH4は、フェニルアラニン水酸化酵素の薬理学的シャペロンとしても作用し、フェニルアラニン水酸化酵素の安定性を増加させる可能性がある。
18.2 効力を裏付ける試験
本剤をフェニルケトン尿症モデルマウスに経口投与したところ、フェニルアラニン水酸化酵素の活性が上昇し、血中フェニルアラニン濃度が低下した。
19. 有効成分に関する理化学的知見
19.1. セピアプテリン
21. 承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
<セピエンス顆粒分包250mg>
30包
<セピエンス顆粒分包1000mg>
30包
23. 主要文献
- 社内資料:第1相PTC923-MD-007-HV試験(承認年月日:2025年12月22日、CTD2.7.2.2)
- 社内資料:第1相PKU-001試験(承認年月日:2025年12月22日、CTD2.7.2.2)
- 社内資料:第3相PTC923-MD-004-PKU試験(承認年月日:2025年12月22日、CTD2.7.2.2,2.7.3.2及び2.7.4.2)
- 社内資料:第1相PTC923-MD-005-HV試験(承認年月日:2025年12月22日、CTD2.7.2.2)
- 社内資料:In vitro PTC923-2021-013試験(承認年月日:2025年12月22日、CTD2.7.2.2)
- 社内資料:母集団薬物動態解析PTC923-2024-115試験(承認年月日:2025年12月22日、CTD2.7.2.3)
- 社内資料:臨床概要(承認年月日:2025年12月22日、CTD2.5.3.1)
- 社内資料:ヒト血漿中代謝物解析PTC923-2022-041試験(承認年月日:2025年12月22日、CTD2.7.2.2)
- 社内資料:第1相マスバランスPTC923-MD-008-HV試験(承認年月日:2025年12月22日、CTD2.7.2.2)
- 社内資料:第1相薬物相互作用PTC923-DDI-101-HV試験(承認年月日:2025年12月22日、CTD2.7.2.2)
- 社内資料:第3相PTC923-MD-003-PKU試験(承認年月日:2025年12月22日、CTD2.7.3.2及び2.7.4.2)
24. 文献請求先及び問い合わせ先
文献請求先
PTCセラピューティクス株式会社
コールセンター
〒103-0023
東京都中央区日本橋本町4-12-20
電話:0120-502-382
製品情報問い合わせ先
PTCセラピューティクス株式会社
コールセンター
〒103-0023
東京都中央区日本橋本町4-12-20
電話:0120-502-382
26. 製造販売業者等
26.1 製造販売元
PTCセラピューティクス株式会社
東京都中央区日本橋本町4-12-20