医薬品情報
| 総称名 | イセルティ |
|---|---|
| 一般名 | リンザゴリクスコリン |
| 欧文一般名 | Linzagolix Choline |
| 製剤名 | リンザゴリクスコリン錠 |
| 薬効分類名 | GnRHアンタゴニスト |
| 薬効分類番号 | 2499 |
| KEGG DRUG |
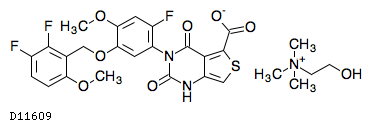
D11609
リンザゴリクスコリン
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年12月 作成(第1版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| イセルティ錠100mg | yselty Tablets 100mg | キッセイ薬品工業 | 24990A6F1020 | 劇薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
子宮筋腫に基づく下記諸症状の改善
過多月経、下腹痛、腰痛、貧血
5. 効能または効果に関連する注意
本剤による治療は根治療法ではないことに留意し、手術が適応となる患者の手術までの保存療法並びに閉経前の保存療法としての適用を原則とすること。
6. 用法及び用量
通常、成人にはリンザゴリクスとして200mgを1日1回経口投与する。なお、初回投与は月経周期1〜5日目に行う。
7. 用法及び用量に関連する注意
7.2 エストロゲン低下作用に基づく骨塩量の低下がみられることがあるので、6ヵ月を超える投与は原則として行わないこと。6ヵ月を超える投与の安全性は確立していない。なお、やむを得ず長期にわたる投与や再投与が必要な場合には、可能な限り骨塩量の検査を行い慎重に投与すること。
8. 重要な基本的注意
投与に際して、類似疾患(悪性腫瘍等)との鑑別に留意し、投与中腫瘤が増大したり、臨床症状の改善がみられない場合は投与を中止すること。[2.2参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 QT間隔延長のおそれ又はその既往歴のある患者
QT間隔延長が起こるおそれがある。[17.3.1参照]
9.1.2 粘膜下筋腫のある患者
観察を十分に行い、異常が認められた場合には適切な処置を行うこと。また、一度に大量の出血が認められた場合には、速やかに医療機関に連絡するよう患者を指導すること。筋腫分娩、重度の不正出血があらわれることがある。
9.2 腎機能障害患者
9.2.1 重度の腎障害のある患者及び末期腎不全患者
本剤の減量を考慮するとともに、患者の状態を慎重に観察し、副作用の発現に十分注意すること。非結合形リンザゴリクスの血中濃度が上昇し、副作用が強くあらわれるおそれがある。[16.6.1参照]
9.2.2 中等度の腎障害のある患者
非結合形リンザゴリクスの血中濃度が上昇し、副作用が強くあらわれるおそれがある。[16.6.1参照]
9.3 肝機能障害患者
9.3.1 重度(Child-Pugh分類C)の肝障害のある患者
本剤を減量するとともに、患者の状態を慎重に観察し、副作用の発現に十分注意すること。非結合形リンザゴリクスの血中濃度が上昇し、副作用が強くあらわれるおそれがある。[16.6.2参照]
9.5 妊婦
9.6 授乳婦
授乳を避けさせること。動物試験(ラット)でリンザゴリクスの乳汁移行が認められており、性腺刺激ホルモンの分泌抑制作用により乳児の生殖機能等の成熟に影響を及ぼすおそれがある。
10. 相互作用
相互作用序文
本剤はCYP2C8に対する弱い阻害作用を有する。[16.7.1参照]
薬物代謝酵素用語
CYP2C8
10.2 併用注意
| 性ホルモン剤(エストラジオール誘導体、エストリオール誘導体、結合型エストロゲン製剤、卵胞ホルモンと黄体ホルモンの合剤、両性混合ホルモン剤等) | 本剤の効果が減弱することがある。 | 本剤は性ホルモンの分泌を低下させることにより薬効を示す。したがって、性ホルモン剤の投与は本剤の治療効果を減弱させる可能性がある。 |
| QT間隔延長を起こすことが知られている薬剤 アジスロマイシン クラリスロマイシン レボフロキサシン等 [17.3.1参照] | QT間隔延長があらわれるおそれがある。 | 併用によりQT間隔延長作用が増強するおそれがある。 |
| CYP2C8の基質となる薬剤 レパグリニド ピオグリタゾン モンテルカスト等 [16.7.1参照] | これらの薬剤の血中濃度が上昇し、副作用が増強する可能性がある。 | 本剤のCYP2C8阻害作用による。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 うつ状態(1%未満)
エストロゲン低下作用に基づく更年期障害様のうつ状態があらわれることがある。
11.2 その他の副作用
| 5%以上 | 1〜5%未満 | 1%未満 | |
| 低エストロゲン症状 | ほてり(52.4%)、多汗症、頭痛 | 閉経期症状、めまい | |
| 女性生殖器及び乳房障害 | 不正出血(38.2%) | 月経異常 | 乳房不快感 |
| 筋・骨格系障害 | 関節痛、手指等のこわばり、生化学的骨代謝マーカー上昇 | 骨密度減少 | |
| 皮膚障害 | 脱毛症 | ||
| 精神・神経系障害 | 傾眠、不眠 | 易刺激性 | |
| 肝障害 | AST、ALT、γ-GTPの上昇、肝機能異常 | ||
| 胃腸障害 | 悪心、便秘 | ||
| 代謝及び栄養障害 | 血中コレステロール増加、血中トリグリセリド増加、低比重リポ蛋白増加、脂質異常症 | 食欲減退 | |
| その他 | 倦怠感 | 動悸、浮腫 |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
閉経前健康女性を対象に本剤200mgを空腹時に単回経口投与したときのリンザゴリクスの薬物動態学的パラメータ及び血漿中濃度推移は以下のとおりであった1)。
| 例数 | Cmax(ng/mL) | Tmaxa)(hr) | AUC0-∞(ng・hr/mL) | t1/2(hr) |
| 5 | 35415.7(14.5) | 2.00(1.25,6.05) | 398692.2(17.0) | 11.438(22.1) |
平均値+標準偏差
16.1.2 反復投与
16.2 吸収
16.2.1 食事の影響
閉経前健康女性22例に対し本剤200mgを高脂肪食摂取後に単回経口投与したとき、空腹時と比べてリンザゴリクスのCmax及びAUC0-∞はそれぞれ0.82倍及び1.00倍であった2)(外国人データ)。
16.3 分布
リンザゴリクスのヒト血漿蛋白結合率は99.0%〜99.4%であった3)(in vitro)。
16.4 代謝
リンザゴリクスは主にCYP2C9、CYP2C8及びCYP3A4により代謝された3)(in vitro)。
16.5 排泄
16.6 特定の背景を有する患者
16.6.1 腎機能障害患者
軽度、中等度及び重度の腎機能障害患者、血液透析を要する末期腎不全患者、並びに腎機能正常被験者に本剤200mgを単回経口投与したとき、腎機能障害の程度がリンザゴリクスの薬物動態に及ぼす影響は以下のとおりであった5)(外国人データ)。[9.2.1、9.2.2参照]
| 軽度腎機能障害a) (n=6) | 中等度腎機能障害b) (n=6) | 重度腎機能障害c) (n=4) | 末期腎不全 (n=6) | |
| 総リンザゴリクス | ||||
| Cmax | 1.03[0.90,1.18] | 1.04[0.82,1.31] | 1.00[0.69,1.44] | 0.83[0.64,1.06] |
| AUC0-∞ | 1.10[0.85,1.42] | 1.19[0.86,1.64] | 1.46[0.98,2.18] | 1.22[0.93,1.60] |
| 非結合形リンザゴリクス | ||||
| Cmax | 1.13[0.89,1.45] | 1.42[0.97,2.07] | 1.39[0.97,2.00] | 1.41[1.12,1.77] |
| AUC0-∞ | 1.21[0.82,1.79] | 1.62[1.01,2.61] | 2.03[1.37,3.01] | 2.10[1.55,2.84] |
16.6.2 肝機能障害患者
軽度、中等度及び重度の肝機能障害患者並びに肝機能正常被験者に本剤200mgを単回経口投与したとき、肝機能障害の程度がリンザゴリクスの薬物動態に及ぼす影響は以下のとおりであった6)(外国人データ)。[9.3.1参照]
| 軽度肝機能障害a) (n=6) | 中等度肝機能障害b) (n=6) | 重度肝機能障害c) (n=6) | |
| 総リンザゴリクス | |||
| Cmax | 0.85[0.70,1.03] | 0.85[0.71,1.02] | 0.93[0.76,1.14] |
| AUC0-∞ | 0.89[0.73,1.09] | 0.82[0.68,0.99] | 1.21[0.97,1.51] |
| 非結合形リンザゴリクス | |||
| Cmax | 0.83[0.66,1.04] | 0.98[0.76,1.26] | 2.22[1.67,2.95] |
| AUC0-∞ | 0.87[0.61,1.24] | 0.94[0.68,1.31] | 2.88[1.76,4.71] |
16.7 薬物相互作用
16.7.1 レパグリニド(CYP2C8基質)
16.7.2 ミダゾラム(CYP3A4基質)
閉経前健康女性22例に本剤200mg(反復経口)とミダゾラム2mg(単回経口)を併用投与したとき、ミダゾラム単独投与時と比較して、ミダゾラムのCmax及びAUC0-∞はそれぞれ0.99倍及び1.02倍であった2)(外国人データ)。
16.7.3 ベンジルペニシリン(OAT3基質)
閉経前健康女性15例に本剤200mg(単回経口)とベンジルペニシリン600mg(単回筋肉内)を併用投与したとき、ベンジルペニシリン単独投与時と比較して、ベンジルペニシリンのCmax及びAUC0-∞はそれぞれ0.96倍及び1.04倍であった8)(外国人データ)。
16.7.4 ピタバスタチン(OATP1B1基質)
健康女性23例に本剤200mg(単回経口)とピタバスタチン1mg(単回経口)を併用投与したとき、ピタバスタチン単独投与時と比較して、ピタバスタチンのCmax及びAUC0-∞はそれぞれ1.21倍及び1.09倍であった9)(外国人データ)。
16.7.5 リファンピシン(OATP1B1/1B3阻害剤)
閉経前健康女性12例に本剤200mg(単回経口)とリファンピシン600mg(単回経口)を併用投与したとき、本剤単独投与時と比較して、リンザゴリクスのCmax及びAUC0-∞はそれぞれ1.14倍及び1.19倍であった10)(外国人データ)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験(KLH2301試験)
過多月経を有する子宮筋腫患者287例を対象に本剤200mgを1日1回24週間経口投与又はリュープロレリン酢酸塩1.88若しくは3.75mg注)を4週に1回24週間皮下投与した。主要評価項目である治験薬投与6週後から12週後までのPictorial Blood Loss Assessment Chart(PBAC)スコアの合計点が10点未満である症例の割合は下表のとおりであり、投与群間差の95%信頼区間の下限が非劣性マージンとして設定した−15%を上回ったことから、本剤のリュープロレリン酢酸塩に対する非劣性が示された。
注)通常1.88mgとされ、体重の重い患者、子宮腫大が高度な患者では3.75mgとされた。
| 投与群 | Na) | PBACスコアの合計点b)が10点未満である症例の割合 | 投与群間差%[95%信頼区間] | |
| n | %[95%信頼区間] | |||
| 本剤群 | 139 | 125 | 89.9[83.7,94.4] | −0.9[−8.6,6.9] |
| リュープロレリン酢酸塩群 | 141 | 128 | 90.8[84.7,95.0] | |
副次評価項目である血中ヘモグロビン(平均値±標準偏差)は、ベースライン(治療期開始時点)及び投与12週時で本剤群11.94±1.39g/dL(143例)及び13.03±1.11g/dL(135例)、リュープロレリン酢酸塩群11.90±1.45g/dL(144例)及び13.09±1.09g/dL(137例)であった。
副作用の発現割合は、本剤群83.9%(120/143例)及びリュープロレリン酢酸塩群91.0%(131/144例)であった。本剤群で主に認められた副作用は、ほてり53.8%(77例)、月経中間期出血37.1%(53例)及び多汗症13.3%(19例)であった11)。
副作用の発現割合は、本剤群83.9%(120/143例)及びリュープロレリン酢酸塩群91.0%(131/144例)であった。本剤群で主に認められた副作用は、ほてり53.8%(77例)、月経中間期出血37.1%(53例)及び多汗症13.3%(19例)であった11)。
17.1.2 国内第III相試験(KLH2302試験)
過多月経及び疼痛症状を有する子宮筋腫患者89例を対象に本剤200mg又はプラセボを1日1回12週間経口投与した。2つの主要評価項目である治験薬投与6週後から12週後までのPBACスコアの合計点が10点未満である症例の割合及び治験薬投与終了前28日間におけるNumerical Rating Scale(NRS)スコア最大値が1以下である症例の割合はそれぞれ下表のとおりであり、いずれの主要評価項目についても本剤のプラセボに対する優越性が示された。
| 投与群 | Na) | PBACスコアの合計点b)が10点未満である症例の割合 | 投与群間差%[95%信頼区間] | P値c) | |
| n | %[95%信頼区間] | ||||
| 本剤群 | 47 | 43 | 91.5[79.6,97.6] | 89.0[76.0,96.2] | p<0.001 |
| プラセボ群 | 40 | 1 | 2.5[0.1,13.2] | ||
| 投与群 | N | NRSスコア最大値a)が1以下である症例の割合 | 投与群間差%[95%信頼区間] | P値b) | |
| n | %[95%信頼区間] | ||||
| 本剤群 | 48 | 34 | 70.8[55.9,83.0] | 61.1[42.1,75.8] | p<0.001 |
| プラセボ群 | 41 | 4 | 9.8[2.7,23.1] | ||
副作用の発現割合は、本剤群81.3%(39/48例)及びプラセボ群41.5%(17/41例)であった。本剤群で認められた主な副作用は、ほてり47.9%(23例)、月経中間期出血41.7%(20例)及び多汗症12.5%(6例)であった12)。
17.3 その他
17.3.1 QT間隔に対する作用
健康成人女性48例を対象に本剤200又は700mg注)を単回経口投与したとき、投与後3時間におけるQTcFのベースラインからの変化量のプラセボとの差の最大値はそれぞれ、8.34msec(90%信頼区間の上限10.23msec)及び9.92msec(90%信頼区間の上限11.81msec)であった。カテゴリカル解析の結果、本剤200及び700mgのいずれも、投与後のQTcF間隔はすべての時点で480msec以下であり、ベースラインからの変化量はすべての時点で30msec以下であった13)(外国人データ)。[9.1.1、10.2参照]
注)本剤の承認されている用法及び用量は「通常、成人にはリンザゴリクスとして200mgを1日1回経口投与する。なお、初回投与は月経周期1〜5日目に行う。」である。
18. 薬効薬理
18.1 作用機序
18.2 ヒトGnRH受容体に対する阻害活性
ヒトGnRH受容体結合試験において、リンザゴリクスはGnRHのヒトGnRH受容体への結合を競合的に阻害した14)(in vitro)。
18.3 GnRH受容体に対する阻害作用
ヒトGnRH受容体機能試験において、リンザゴリクスはGnRH刺激による細胞内カルシウム濃度上昇を濃度依存的に阻害した14)(in vitro)。
18.4 視床下部−下垂体−性腺軸に対する作用
18.5 LH、FSH、E2濃度抑制作用
閉経前健康女性(5例)に本剤200mgを単回経口投与(1日目)し、その後1日1回反復経口投与(3〜8日目)したとき、LH(黄体形成ホルモン)、FSH(卵胞刺激ホルモン)、E2は投与1日以内に低下した。また、E2は反復投与期間を通じて低く推移した。E2の濃度推移は以下のとおりであった1)。
19. 有効成分に関する理化学的知見
19.1. リンザゴリクスコリン
21. 承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
100錠[10錠(PTP)×10]
23. 主要文献
- 社内資料:第I相臨床試験(2025年12月22日承認、CTD2.7.6.2)
- 社内資料:薬物相互作用(CYP3A4基質)及び食事の影響試験(2025年12月22日承認、CTD2.7.6.6)
- 社内資料:薬物動態試験(2025年12月22日承認、CTD2.6.4)
- 社内資料:マスバランス試験(2025年12月22日承認、CTD2.7.6.3)
- 社内資料:腎機能低下者試験(2025年12月22日承認、CTD2.7.6.5)
- 社内資料:肝機能低下者試験(2025年12月22日承認、CTD2.7.6.4)
- 社内資料:薬物相互作用試験(CYP2C8基質)(2025年12月22日承認、CTD2.7.6.8)
- 社内資料:薬物相互作用試験(OAT3基質)(2025年12月22日承認、CTD2.7.6.9)
- 社内資料:薬物相互作用試験(OATP1B1基質)(2025年12月22日承認、CTD2.7.6.10)
- 社内資料:薬物相互作用試験(OATP1B1/1B3阻害薬)(2025年12月22日承認、CTD2.7.6.7)
- 社内資料:国内第III相試験(KLH2301)(2025年12月22日承認、CTD2.7.6.12)
- 社内資料:国内第III相試験(KLH2302)(2025年12月22日承認、CTD2.7.6.13)
- 社内資料:QT/QTc試験(2025年12月22日承認、CTD2.7.6.11)
- 社内資料:薬理試験(2025年12月22日承認、CTD2.6.2.2)
- Tezuka,M.et al., Clin Exp Pharmacol Physiol., 49 (10), 1082-1093, (2022) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
キッセイ薬品工業株式会社
くすり相談センター
〒112-0002
東京都文京区小石川3丁目1番3号
電話:フリーダイヤル:0120-007-622
製品情報問い合わせ先
キッセイ薬品工業株式会社
くすり相談センター
〒112-0002
東京都文京区小石川3丁目1番3号
電話:フリーダイヤル:0120-007-622
26. 製造販売業者等
26.1 製造販売元
キッセイ薬品工業株式会社
松本市芳野19番48号