医薬品情報
| 総称名 | アップニーク |
|---|---|
| 一般名 | オキシメタゾリン塩酸塩 |
| 欧文一般名 | Oxymetazoline Hydrochloride |
| 製剤名 | オキシメタゾリン塩酸塩点眼液 |
| 薬効分類名 | 後天性眼瞼下垂治療剤(ミュラー筋作用・眼瞼挙上点眼薬) |
| 薬効分類番号 | 1319 |
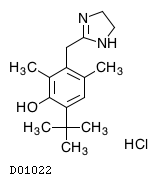
| KEGG DRUG |
D01022
オキシメタゾリン塩酸塩
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年12月 作成(第1版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| アップニークミニ点眼液0.1% | UPNEEQ Mini ophthalmic solution | 参天製薬 | 131970CQ1020 |
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
後天性眼瞼下垂
5. 効能または効果に関連する注意
5.1 後天性眼瞼下垂の原因が腱膜性以外と考えられる場合(脳卒中、脳動脈瘤、ホルネル症候群、重症筋無力症、皮膚弛緩症等)は、それらの疾患に対する治療を優先すること。
5.2 「17.臨床成績」の項の内容を熟知し、臨床試験に組み入れられた患者の背景(MRD-1注)、病型等)を十分に理解した上で、適応患者を選択すること。[17.1.1参照]
注)Marginal Reflex Distance-1(上瞼縁角膜反射距離):瞳孔中心から上眼瞼縁までの距離
5.3 定期的に眼瞼の位置(MRD-1)の変化及び患者の主訴(眼瞼が重い、眼瞼が下がって見えづらい等)の変化を評価し、効果が認められない場合には、投与を中止すること。
6. 用法及び用量
通常、成人には、1回1滴、1日1回点眼する。
8. 重要な基本的注意
8.1 本剤を6ヵ月を超えて点眼した際の有効性及び安全性は検討されていない。
8.2 本剤の使用により、散瞳が生じる可能性がある。散瞳が生じた場合には、その症状が回復するまでは自転車・自動車等の運転、機械類の操作は避けるよう注意すること。また、必要に応じてサングラスを着用する等、太陽光や強い光を直接見ないよう指導すること。
8.3 本剤による後天性眼瞼下垂の治療に際して、眼瞼に炎症所見(眼瞼腫脹、発赤等)が認められる場合は、これらの症状が治まってから使用すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 心血管系疾患のある患者
血圧及び脈拍数の変動により、症状が悪化するおそれがある。
9.1.2 閉塞隅角緑内障の患者
急性閉塞隅角緑内障の発作を起こすおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット:経口投与)で乳汁中への移行が報告されている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
10. 相互作用
10.2 併用注意
| モノアミン酸化酵素(MAO)阻害剤 セレギリン塩酸塩 ラサギリンメシル酸塩 サフィナミドメシル酸塩等 | 急激な血圧上昇を起こすおそれがある。 | MAO阻害剤の投与を受けている患者ではノルアドレナリンの蓄積が増大しているため、併用した場合急激な血圧上昇が起こるおそれがある。 |
| 降圧剤 | 降圧作用が増強される可能性がある。 | 併用した場合に相加的に降圧作用が増強されると考えられる。 |
| 強心配糖体 ジゴキシン等 | 血圧または脈拍数の上昇作用が増強される可能性がある。 | 併用した場合に血圧または脈拍数の上昇作用が増強されると考えられる。 |
11. 副作用
11.2 その他の副作用
| 1%未満 | 頻度不明 | |
| 眼 | 眼瞼そう痒感 | 結膜充血、点状角膜炎、霧視、結膜浮腫、眼瞼湿疹、視力障害 |
| 循環器 | 血圧上昇、心拍数減少 |
13. 過量投与
本剤の経口での摂取により胃腸障害、呼吸器障害、心臓障害、意識障害を引き起こす可能性がある。小児がオキシメタゾリン等のイミダゾリン誘導体を含む点眼液等を誤飲した際に、悪心、嘔吐、嗜眠、頻脈、呼吸数減少、徐脈、低血圧、高血圧、鎮静、傾眠、散瞳、昏迷、低体温、よだれ、昏睡等が認められたとの海外報告がある。[14.1参照]
14. 適用上の注意
14.1 薬剤交付時の注意
患者に対し以下の点に注意するよう指導すること。
・開封時の容器破片除去のため、使用の際は、最初の1〜2滴は点眼せずに捨てること。
・点眼のとき、容器の先端が直接目に触れないように注意すること。
・患眼を開瞼して結膜嚢内に点眼し、1〜5分間閉瞼して涙嚢部を圧迫させた後、開瞼すること。
・他の点眼剤を併用する場合には、少なくとも5分以上間隔をあけてから点眼すること。
・保存剤を含有しないため、開封後は1回きりの使用とし、残液は廃棄すること。
・遮光して保存すること。
・小児の手の届かないところに保管すること。[13.参照]
16. 薬物動態
16.1 血中濃度
0.1%オキシメタゾリン塩酸塩点眼液注)を健康成人男女12例の両眼に単回1滴点眼したとき、血漿中オキシメタゾリン濃度の薬物動態パラメータは表1のとおりであった1)。
| Cmax(pg/mL) | tmaxa(h) | t1/2b(h) | AUClast(pg・h/mL) |
| 33.7±7.77 | 1.01(0.33,6.00) | 7.20±0.418 | 362±130 |
注)本剤とは同一処方だが1滴量が異なる。
16.3 分布
白色ウサギの両眼に0.025%14C-オキシメタゾリン塩酸塩点眼液を単回点眼したとき、眼組織中14C濃度は瞬膜が最も高く、次いで結膜及び角膜、強膜、虹彩、毛様体、網脈絡膜、視神経、房水、水晶体、硝子体液の順であった2)。
16.4 代謝
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験
後天性眼瞼下垂患者注1)(有効性解析対象336例)を対象とした、無作為化二重遮蔽比較試験において、本剤またはプラセボ点眼液を1回1滴、1日1回又は2回注2)、6ヵ月間(治療I期:3ヵ月間+治療II期:3ヵ月間)両眼に投与した注3)。主要評価項目である投与14日後(朝点眼2時間後)におけるベースライン(投与開始日0時間値)からのMRD-1注4)の変化量について、本剤1日1回投与群のプラセボ群に対する優越性が検証された(表2)。また、投与6ヵ月後までのベースラインからのMRD-1の変化量の推移は図1のとおりであった。
副作用は、本剤1日1回点眼群112例中1例(0.9%)に眼瞼そう痒感が認められた5)。
副作用は、本剤1日1回点眼群112例中1例(0.9%)に眼瞼そう痒感が認められた5)。
注1)MRD-1が2mm以下の後天性眼瞼下垂患者。ただし、重症筋無力症、ホルネル症候群、Marcus Gunn jaw-winking症候群、皮膚弛緩症等の偽性眼瞼下垂及び機械性眼瞼下垂(眼窩又は眼瞼腫瘍、上眼瞼の動きに影響を与える瘢痕過程、及び眼球陥凹による眼瞼下垂を含む)等の患者、眼瞼下垂手術の既往を有する患者は除外された。
注2)本剤の承認用法及び用量は「通常、成人には、1回1滴、1日1回点眼する。」である。
注3)治療I期でプラセボ点眼液が投与された被験者は、治療II期では本剤を1日1回又は2回投与された。
注4)Marginal Reflex Distance-1(上瞼縁角膜反射距離):前眼部撮影画像で特定される瞳孔中心から上眼瞼縁までの距離をMRD-1と定義し、測定した。
| 本剤(112例) | プラセボ(112例) | |
| ベースラインからの変化量(投与14日後朝点眼後2時間) | 1.09±0.07 | 0.50±0.07 |
| 群間差[95%信頼区間](本剤群−プラセボ群) p値 | 0.59±0.10[0.38,0.79] p<0.0001 | |
図1. MRD-1のベースラインからの変化量の推移(平均値±標準誤差)
注5)プラセボ群は3ヵ月間投与後、本剤群へ切り替え、6ヵ月後まで投与した。
18. 薬効薬理
19. 有効成分に関する理化学的知見
19.1. オキシメタゾリン塩酸塩
20. 取扱い上の注意
アルミピロー包装開封後は、添付の遮光用投薬袋に入れて室温で保存し、3ヵ月以内に使用すること。
21. 承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
プラスチック点眼容器 0.3mL×30本(アルミピロ−1袋10本入り×3袋、脱酸素剤入り)
23. 主要文献
- 社内資料:海外第I相PK試験(RVL-1201-PKP02)(2025年12月22日承認、CTD2.7.6.1)
- Duzman E,et al., Topically applied oxymetazoline.Ocular vasoconstrictive activity,pharmacokinetics,and metabolism.Arch Ophthalmol., 101, 1122-6, (1983)
- Mahajan MK,et al., In vitro metabolism of oxymetazoline:evidence for bioactivation to a reactive metabolite.Drug Metab Dispos., 39, 693-702, (2011)
- Mahajan MK,et al., Identification and characterization of oxymetazoline glucuronidation in human liver microsomes:evidence for the involvement of UGT1A9.J Pharm Sci., 100, 784-93, (2011)
- 社内資料:国内第III相試験(101380001LT)(2025年12月22日承認、CTD2.7.6.2)
- 社内資料:受容体結合親和性(2025年12月22日承認、CTD2.6.2.2.1)
- 社内資料:作用機序(2025年12月22日承認、CTD2.6.2.2.2)
24. 文献請求先及び問い合わせ先
文献請求先
参天製薬株式会社
製品情報センター 受付時間 9:00〜17:00(土・日・祝日を除く)
〒530-8552(個別郵便番号)
大阪市北区大深町4-20
電話:0120-921-839
06-7664-8624
06-7664-8624
製品情報問い合わせ先
参天製薬株式会社
製品情報センター 受付時間 9:00〜17:00(土・日・祝日を除く)
〒530-8552(個別郵便番号)
大阪市北区大深町4-20
電話:0120-921-839
06-7664-8624
06-7664-8624
25. 保険給付上の注意
本剤は保険給付の対象とならない(薬価基準未収載)。
26. 製造販売業者等
26.1 製造販売元
参天製薬株式会社
大阪市北区大深町4-20
その他の説明
アップニークミニ点眼液0.1%の使用方法
1)1回分(1本分)の容器を切り離してください。
2)図の様に薬液が入っていない部分を持ち、容器の先端をねじって、切り外してください。
3)点眼する前に、1〜2滴捨ててください。
4)下まぶたを軽く下にひき、まぶたやまつ毛、目に触れないように点眼してください。
両根に点眼する必要がある場合は、そのままもう片側に点眼してください。
両根に点眼する必要がある場合は、そのままもう片側に点眼してください。