医薬品情報
| 総称名 | アイトロール |
|---|---|
| 一般名 | 一硝酸イソソルビド |
| 欧文一般名 | Isosorbide Mononitrate |
| 薬効分類名 | 狭心症治療用ISMN製剤 |
| 薬効分類番号 | 2171 |
| ATCコード | C01DA14 |
| KEGG DRUG |
D00630
一硝酸イソソルビド
|
| KEGG DGROUP |
DG01270
硝酸イソソルビド
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年10月 改訂(第3版)

|
2.禁忌 4.効能または効果 5.効能又は効果に関連する注意 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| アイトロール錠10mg | Itorol Tablets 10mg | トーアエイヨー | 2171023F1023 | 10.4円/錠 | 処方箋医薬品注) |
| アイトロール錠20mg | Itorol Tablets 20mg | トーアエイヨー | 2171023F2020 | 10.4円/錠 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 重篤な低血圧又は心原性ショックのある患者[血管拡張作用により更に血圧を低下させ、症状を悪化させるおそれがある。][9.1.1参照]
2.2 閉塞隅角緑内障の患者[眼圧を上昇させるおそれがある。]
2.3 頭部外傷又は脳出血のある患者[頭蓋内圧を上昇させるおそれがある。]
2.4 高度な貧血のある患者[血圧低下により貧血症状(めまい、立ちくらみ等)を悪化させるおそれがある。]
2.5 硝酸・亜硝酸エステル系薬剤に対し過敏症の既往歴のある患者
2.6 ホスホジエステラーゼ5阻害作用を有する薬剤(シルデナフィルクエン酸塩、バルデナフィル塩酸塩水和物、タダラフィル)又はグアニル酸シクラーゼ刺激作用を有する薬剤(リオシグアト)を投与中の患者[10.1参照]
4. 効能または効果
5. 効能または効果に関連する注意
本剤は狭心症の発作寛解を目的とした治療には不適であるので、この目的のためには速効性の硝酸・亜硝酸エステル系薬剤を使用すること。
6. 用法及び用量
通常、成人には一硝酸イソソルビドとして1回20mg1日2回を経口投与する。なお、年齢、症状により適宜増減するが、効果不十分な場合には1回40mg1日2回まで増量できる。
ただし、労作狭心症又は労作兼安静狭心症で発作回数及び運動耐容能の面で重症と判断された場合には1回40mg1日2回を経口投与できる。
ただし、労作狭心症又は労作兼安静狭心症で発作回数及び運動耐容能の面で重症と判断された場合には1回40mg1日2回を経口投与できる。
8. 重要な基本的注意
8.1 本剤の投与に際しては、症状及び経過を十分に観察し、狭心症発作が増悪するなど効果が認められない場合には他の療法に切りかえること。
8.2 硝酸・亜硝酸エステル系薬剤を使用中の患者で、急に投与を中止したとき症状が悪化した症例が報告されているので、休薬を要する場合には他剤との併用下で徐々に投与量を減じること。
また、患者に医師の指示なしに使用を中止しないよう注意すること。
また、患者に医師の指示なしに使用を中止しないよう注意すること。
8.3 過度の血圧低下が起こった場合には、本剤の投与を中止し、下肢の挙上あるいは昇圧剤の投与等、適切な処置を行うこと。
8.4 起立性低血圧を起こすことがあるので注意すること。
8.5 本剤の投与開始時には、他の硝酸・亜硝酸エステル系薬剤と同様に血管拡張作用による頭痛等の副作用を起こすことがある。このような場合には鎮痛剤を投与するか、減量又は投与中止するなど適切な処置を行うこと。
また、これらの副作用のために注意力、集中力、反射運動能力等の低下が起こることがあるので、このような場合には、自動車の運転等の危険を伴う機械の操作に従事させないよう注意すること。
また、これらの副作用のために注意力、集中力、反射運動能力等の低下が起こることがあるので、このような場合には、自動車の運転等の危険を伴う機械の操作に従事させないよう注意すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 低血圧の患者(重篤な低血圧のある患者を除く)
血管拡張作用により更に血圧を低下させるおそれがある。[2.1参照]
9.1.2 原発性肺高血圧症の患者
心拍出量が低下しショックを起こすおそれがある。
9.1.3 肥大型閉塞性心筋症の患者
心室内圧較差の増強をもたらし、症状を悪化させるおそれがある。
9.3 肝機能障害患者
副作用が発現しやすくなる。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。動物実験(ラット)で大量投与により、胎児及び出生児の体重増加抑制、出生児生存率の低下、発育・分化の遅延が報告されている1)。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。動物実験(ラット)で乳汁中へ移行することが報告されている2)。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
頭痛等の副作用の発現がないことを確認しながら必要に応じて低用量(例えば1回10mg)より投与を開始し、増量するなど慎重に投与すること。本剤は他の硝酸・亜硝酸エステル系薬剤に比べて肝臓での初回通過効果を受けにくいが、一般に肝・腎機能が低下していることが多い。
10. 相互作用
10.1 併用禁忌
| ホスホジエステラーゼ5阻害作用を有する薬剤 シルデナフィルクエン酸塩 (バイアグラ、レバチオ) バルデナフィル塩酸塩水和物 (レビトラ) タダラフィル (シアリス、アドシルカ、ザルティア) [2.6参照] | 併用により、降圧作用を増強することがある。 本剤投与前にこれらの薬剤を服用していないことを十分確認すること。また、本剤投与中及び投与後においてこれらの薬剤を服用しないよう十分注意すること。 | 本剤はcGMPの産生を促進し、一方、ホスホジエステラーゼ5阻害作用を有する薬剤はcGMPの分解を抑制することから、両剤の併用によりcGMPの増大を介する本剤の降圧作用が増強する。 |
| グアニル酸シクラーゼ刺激作用を有する薬剤 リオシグアト (アデムパス) [2.6参照] | 併用により、降圧作用を増強することがある。 本剤投与前にこれらの薬剤を服用していないことを十分確認すること。また、本剤投与中及び投与後においてこれらの薬剤を服用しないよう十分注意すること。 | 本剤とグアニル酸シクラーゼ刺激作用を有する薬剤は、ともにcGMPの産生を促進することから、両剤の併用によりcGMPの増大を介する本剤の降圧作用が増強する。 |
10.2 併用注意
| アルコール摂取 | 血圧低下等が増強されるおそれがある。 | 血管拡張作用が増強される。 |
| 利尿剤 | 血圧低下等が増強されるおそれがある。 | 血圧低下作用を増強させる。 |
| 血管拡張剤 硝酸・亜硝酸エステル系薬剤 | 頭痛、血圧低下等の副作用が増強されるおそれがある。 | 血管拡張作用が増強される。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 肝機能障害、黄疸(いずれも頻度不明)
AST、ALT、γ-GTPの上昇等を伴う肝機能障害、黄疸があらわれることがある。
11.2 その他の副作用
| 2%以上 | 2%未満 | 頻度不明 | |
| 循環器 | めまい・ふらつき、動悸 | 血圧低下、浮腫、熱感 | |
| 精神神経系 | 頭痛(13.4%) | 不眠、全身倦怠感 | 頭重感、しびれ |
| 過敏症 | 発疹、そう痒感 | ||
| 消化器 | 胃もたれ、腹部膨満感、鼓腸、口内乾燥、嘔気 | 食欲不振、腹痛、下痢、嘔吐 | |
| 肝臓 | ALT上昇、AST上昇、LDH上昇 | ||
| その他 | BUN上昇 | CK上昇、クレアチニン上昇、筋肉痛 |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔をおこして縦隔洞炎等の重篤な合併症を併発することがある。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 本剤使用中に本剤又は他の硝酸・亜硝酸エステル系薬剤に対し、耐薬性を生じ、作用が減弱することがある。
なお、類似化合物(ニトログリセリン)の経皮吸収型製剤での労作狭心症に対するコントロールされた外国の臨床試験成績によると、休薬時間を置くことにより、耐薬性が軽減できたとの報告がある3)。
なお、類似化合物(ニトログリセリン)の経皮吸収型製剤での労作狭心症に対するコントロールされた外国の臨床試験成績によると、休薬時間を置くことにより、耐薬性が軽減できたとの報告がある3)。
15.1.2 類似化合物(硝酸イソソルビド)の投与によって、メトヘモグロビン血症があらわれたとの報告がある。
15.1.3 狭心症患者を対象とした比較試験において、本剤はカルシウム拮抗剤(ニフェジピン)に比べ、必ずしも優る薬剤ではなく、硝酸イソソルビド徐放錠と同等であると判断された。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人男子(6例)に一硝酸イソソルビドとして10注1)、20及び40mgを経口投与したとき、血漿中濃度は投与後2時間でほぼCmaxに達し、T1/2は5〜6時間であった。なお、Cmax及びAUCは投与量に比例して増加した4)。
| Cmax(ng/mL) | Tmax(hr) | T1/2(hr) | AUC0→∞(ng・hr/mL) | |
| 10mg | 157.2±29.7 | 1.8±0.7 | 5.5±0.5 | 1701±263 |
| 20mg | 373.3±29.3 | 1.7±0.4 | 5.0±0.3 | 3306±391 |
| 40mg | 709.7±107.3 | 1.5±0.4 | 6.0±0.2 | 6525±951 |
健康成人男子に一硝酸イソソルビドとして10注1)、20及び40mgを経口投与したときの血漿中濃度推移(平均値±標準偏差、n=6)
16.1.2 反復投与
健康成人男子(6例)に一硝酸イソソルビド20mgを12時間間隔で7回反復経口投与したときの最低血漿中濃度は、130〜150ng/mLの一定範囲内にあり、漸増する傾向は認められなかった4)。
16.2 吸収
16.2.1 食事の影響
健康成人男子(3例)に12時間絶食後及び摂食1.5時間後に一硝酸イソソルビド10mg注1)を単回経口投与した結果、摂食により一硝酸イソソルビドのCmaxは低下し、Tmaxは延長する傾向を示したが、T1/2及びAUCには差が認められなかったことから、摂食による一硝酸イソソルビドの薬物動態に及ぼす影響は少ないものと考えられた4)。
16.3 分布
16.3.1 血漿蛋白結合率
虚血性心疾患患者注2)(28例)に投与したときの血漿蛋白結合率は約2〜4%であった(投与3時間後、限外濾過法)5)。
16.4 代謝
健康成人男子(3例)に一硝酸イソソルビド40mgを単回経口投与したとき、投与48時間までの尿中に投与量の29.0%が一硝酸イソソルビドのグルクロン酸抱合体として、42.0%がイソソルビドとして、2.0%が未変化体としてそれぞれ排泄された6)。
16.5 排泄
ほぼ完全に代謝された後、主として尿中に排泄される。
注1)本剤の承認された用法及び用量は1回20mg1日2回経口投与である(効果不十分な場合は1回40mg1日2回まで増量)。
注2)本剤の承認された効能又は効果は狭心症である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第III相試験
狭心症患者(206例)を対象に、本剤20mg又は硝酸イソソルビド徐放錠20mgを1日2回、2週間投与した二重盲検比較試験を行った。その結果、硝酸イソソルビド徐放錠と同等であると判断された。
本剤投与群の副作用発現頻度は11.8%(13/110例)であり、主な副作用は頭痛9.1%(10/110例)であった。両群間の副作用発現率に有意差は認められなかった7)。
本剤投与群の副作用発現頻度は11.8%(13/110例)であり、主な副作用は頭痛9.1%(10/110例)であった。両群間の副作用発現率に有意差は認められなかった7)。
18. 薬効薬理
18.1 作用機序
18.2 血管拡張作用
一硝酸イソソルビドは、ウサギの摘出胸部大動脈及び腹部大静脈において用量依存的な血管弛緩作用を示し、血管組織内のcGMP含量を増加した。このような血管弛緩作用は静脈血管に対して高い選択性を有し、cGMP含量の増加も動脈より静脈において著明であった8)。
18.3 血行動態に対する作用
18.3.1 一硝酸イソソルビドは、麻酔イヌにおいて静脈血管の拡張作用に起因する静脈還流量の減少により心臓の前負荷を減少し、また、全末梢血管抵抗の減少により後負荷を減少した。更に、心筋収縮力に対して直接的な影響を与えず、冠血流量を用量依存的に増加した9)10)。
18.3.2 無麻酔イヌに一硝酸イソソルビドを経口投与した場合、用量依存的な脈圧減少作用を示し、生物学的利用率も高かった。血漿中一硝酸イソソルビド濃度と脈圧減少作用の間には正の相関がみられた11)。
18.3.3 本剤は狭心症患者の安静時の肺動脈楔入圧及び左室拡張末期容積を有意に減少させ、運動負荷試験中の肺動脈楔入圧及び左室拡張末期容積の増加を有意に抑制した12)。
18.4 虚血時の心電図及び運動耐容能に対する作用
18.4.1 一硝酸イソソルビドは、労作狭心症の病態モデルの1つと考えられているコレステロール餌負荷ウサギのhigh-pacingによるST下降を著明に抑制した。
18.4.2 本剤は労作狭心症患者のトレッドミル運動負荷試験において、運動耐容能を有意に延長(p<0.01)し、その作用は7時間以上持続した。また、血漿中一硝酸イソソルビド濃度と運動持続時間の増加との間には正の相関が示された13)。
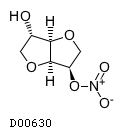
19. 有効成分に関する理化学的知見
19.1. 一硝酸イソソルビド
22. 包装
<アイトロール錠10mg>
100錠[PTP(10錠×10)]
1,000錠[PTP(10錠×100)]
1,000錠[バラ]
<アイトロール錠20mg>
100錠[PTP(10錠×10)]
1,000錠[PTP(10錠×100)]
1,400錠[PTP(14錠×100)]
1,000錠[バラ]
23. 主要文献
- 桶谷米四郎ほか, 基礎と臨床, 20 (14), 6911-6928, (1986)
- 江角凱夫ほか, 応用薬理, 35 (1), 71-81, (1988)
- Demots H,et al., J Am Coll Cardiol., 13 (4), 786-793, (1989) »PubMed
- 田原一二ほか, 臨床薬理, 15 (2), 317-328, (1984) »DOI
- 坂井誠ほか, TDM研究, 14 (3), 253-259, (1997)
- 千田敏ほか, 応用薬理, 29 (4), 517-521, (1985)
- 山田和生ほか, Geriat Med., 23 (8), 1421-1435, (1985)
- 松岡功ほか, Eur J Pharmacol., 118 (1-2), 155-161, (1985) »PubMed
- 古城健太郎ほか, 日本薬理学雑誌, 85 (5), 335-342, (1985) »PubMed
- 古城健太郎ほか, 日本薬理学雑誌, 86 (4), 315-321, (1985) »PubMed
- 古城健太郎ほか, Jpn J Pharmacol., 44 (3), 249-257, (1987) »PubMed
- 恒川純ほか, 臨床薬理, 16 (2), 427-435, (1985) »DOI
- 外畑巖ほか, 臨床薬理, 16 (3), 631-646, (1985) »DOI
24. 文献請求先及び問い合わせ先
文献請求先
トーアエイヨー株式会社
くすり相談窓口
〒104-0032
東京都中央区八丁堀3-10-6
電話:0120-387-999
製品情報問い合わせ先
トーアエイヨー株式会社
くすり相談窓口
〒104-0032
東京都中央区八丁堀3-10-6
電話:0120-387-999
26. 製造販売業者等
26.1 製造販売元
トーアエイヨー株式会社
福島県福島市飯坂町湯野字田中1番地