医薬品情報
| 総称名 | デキストラン |
|---|---|
| 一般名 | デキストラン40 |
| 欧文一般名 | Dextran 40 |
| 製剤名 | 10%デキストラン40加乳酸リンゲル液 |
| 薬効分類名 | 血漿増量・体外循環灌流液 |
| 薬効分類番号 | 3319 |
| JAPIC | 添付文書(PDF) |
添付文書情報2023年3月 改訂(第1版)

|
2.禁忌 4.効能または効果 6.用法及び用量 7.用法及び用量に関連する注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 12.臨床検査結果に及ぼす影響 14.適用上の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 20.取扱い上の注意 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| 低分子デキストランL注 | LOW MOLECULAR DEXTRAN L INJECTION | 大塚製薬工場 | 3319536A3022 | 751円/袋 | 処方箋医薬品注) |
| 低分子デキストランL注 | LOW MOLECULAR DEXTRAN L INJECTION | 大塚製薬工場 | 3319536A4029 | 440円/袋 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 うっ血性心不全の患者[循環血液量の増加により、症状が悪化するおそれがある。]
2.2 高乳酸血症の患者[高乳酸血症が悪化するおそれがある。]
4. 効能または効果
○体外循環灌流液として用い、灌流を容易にして手術中の併発症の危険を減少する
○代用血漿として急性出血の治療、特に急性大量出血の際の初期治療として有効
○外傷、熱傷、出血などに基づく外科的ショックの予防及び治療
○手術時における輸血量の節減
6. 用法及び用量
通常1回500mLを緩徐に静脈内に注射する。
なお、年齢、体重、症状に応じて適宜増減する。
なお、年齢、体重、症状に応じて適宜増減する。
体外循環灌流液として用いる場合は、体重kg当たりデキストラン40として2〜3g(20〜30mL)を注入する。
7. 用法及び用量に関連する注意
長期連用を避けること(できるだけ短期投与にとどめ、5日以内とする)。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 脱水状態の患者
腎機能障害発現の誘因となるおそれがある。
9.1.2 肺水腫の患者
水分、電解質が肺細胞間質に滞留し、肺水腫が悪化するおそれがある。
9.1.3 低フィブリノーゲン血症、血小板減少症等の出血傾向のある患者
凝固系を抑制して出血傾向を促進するおそれがある。
9.1.4 閉塞性尿路疾患により尿量が減少している患者
水分、電解質等の排泄が障害されているため、症状が悪化するおそれがある。
9.2 腎機能障害患者
腎障害が悪化するおそれがある。
9.3 肝機能障害患者
9.3.1 重篤な肝障害のある患者
水分、電解質代謝異常が悪化するおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
9.8 高齢者
投与速度を緩徐にし、減量するなど注意すること。一般に生理機能が低下している。
10. 相互作用
10.2 併用注意
| 腎障害を起こすおそれのあるアミノ糖系抗生物質 カナマイシン、ゲンタマイシン 等 | 乏尿など腎に異常が認められた場合には、投与を中止し、持続的血液濾過透析法、血漿交換、血液透析等の適切な処置を行うこと。 | これら抗生物質の腎毒性を増強することがある。脱水条件が加わると腎毒性がより増強される。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック(頻度不明)
血圧降下、脈拍の異常、呼吸抑制等があらわれた場合には、直ちに投与を中止し、適切な処置を行うこと。
11.1.2 急性腎障害(頻度不明)
乏尿などの異常が認められた場合には投与を中止し、持続的血液濾過透析法、血漿交換、血液透析等の適切な処置を行うこと。
11.1.3 過敏症(頻度不明)
アナフィラキシー等の過敏症状があらわれた場合には投与を中止し、適切な処置を行うこと。
11.2 その他の副作用
| 頻度不明 | |
| 血液(大量投与又は連用) | 出血時間延長、出血傾向 |
| 胃腸 | 悪心・嘔吐 |
| 皮膚 | 蕁麻疹 |
| 大量・急速投与 | 脳浮腫、肺水腫、末梢の浮腫 |
12. 臨床検査結果に及ぼす影響
血液型判定又は交差試験を妨害することがあるので、これらの試験を行う必要がある場合には、本剤の投与前に実施することが望ましい。
14. 適用上の注意
14.1 全般的な注意
14.1.1 使用時には、感染に対する配慮をすること。
14.1.2 注射針や輸液セットのびん針は、ゴム栓の刻印部(○印)に垂直にゆっくりと刺すこと。斜めに刺した場合、削り片の混入及び液漏れの原因となるおそれがある。また、針は同一箇所に繰り返し刺さないこと。
14.2 薬剤調製時の注意
薬剤を配合する場合には、配合変化に注意すること。
14.3 薬剤投与時の注意
14.3.1 皮下投与しないこと。
14.3.2 原則として、連結管を用いたタンデム方式による投与は行わないこと。輸液セット内に空気が流入するおそれがある。
14.3.3 容器の目盛りは目安として使用すること。
14.3.4 残液は使用しないこと。
16. 薬物動態
16.1 血中濃度
健康成人に本剤250mLを肘静脈より1時間投与した結果、血液中デキストラン40の濃度は投与終了時に312.3mg/dLに達した後、3時間後に半減し、24時間後には28.7mg/dLまで減少した1)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
18. 薬効薬理
18.1 作用機序
本剤はデキストラン40の有する膠質浸透圧に基づく水分保持機能による血漿量の増加並びにコロイドによる血中滞留時間の持続により、血漿増量効果を持続させる。
晶質液成分である乳酸リンゲル液は、電解質を補給し、細胞外液の損失を補う。
晶質液成分である乳酸リンゲル液は、電解質を補給し、細胞外液の損失を補う。
18.2 血漿増量作用
成犬を用い、脱血及び等量の本剤注入操作を繰返して血液希釈を行った試験において、循環血漿量及び細胞外液量の増加が認められた5)。
18.3 酸塩基平衡、電解質バランスの維持
脱血成犬において、本剤は10%デキストラン40加5%ブドウ糖液に対し、酸塩基平衡障害及び血清電解質(Na+、Cl−)濃度の減少を抑制した6)。
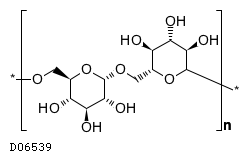
19. 有効成分に関する理化学的知見
19.1. デキストラン40
20. 取扱い上の注意
20.1 液漏れの原因となるので、強い衝撃や鋭利なものとの接触等を避けること。
20.2 保存中の温度変化による局部的濃縮のため、まれに不溶性デキストラン(鱗片状又は凝縮物)を析出することがあるので、以下の点に留意すること。
・温度変化の少ない場所で保存すること。例えばクーラーの吹き出し口付近等、温度変化の著しい場所での保存は避けること。
・不溶性デキストランの析出は、ゴム栓とソフトバッグ容器内壁との接触溝付近で発生しやすいため7)、横積み状態での保存に努めること。
・温度変化の影響を少なくするため、外袋は開封しないことが望ましい。
20.3 以下の場合には使用しないこと。
・外袋内や容器表面に水滴や結晶が認められる場合
・容器から薬液が漏れている場合
・不溶性デキストランの析出が認められる場合
・性状その他薬液に異状が認められる場合
・ゴム栓部のシールがはがれている場合
22. 包装
250mL 20袋 ソフトバッグ
500mL 20袋 ソフトバッグ
23. 主要文献
24. 文献請求先及び問い合わせ先
文献請求先
株式会社大塚製薬工場
輸液DIセンター
〒101-0048
東京都千代田区神田司町2-2
電話:0120-719-814
FAX:03-5296-8400
製品情報問い合わせ先
株式会社大塚製薬工場
輸液DIセンター
〒101-0048
東京都千代田区神田司町2-2
電話:0120-719-814
FAX:03-5296-8400
26. 製造販売業者等
26.1 製造販売元
株式会社大塚製薬工場
徳島県鳴門市撫養町立岩字芥原115
26.2 販売提携
大塚製薬株式会社
東京都千代田区神田司町2-9