医薬品情報
| 総称名 | テラルビシン |
|---|---|
| 一般名 | ピラルビシン |
| 欧文一般名 | Pirarubicin |
| 製剤名 | 注射用ピラルビシン塩酸塩 |
| 薬効分類名 | 抗悪性腫瘍抗生物質製剤 |
| 薬効分類番号 | 4235 |
| ATCコード | L01DB08 |
| KEGG DRUG |
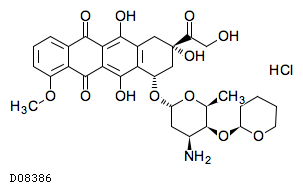
D08386
ピラルビシン塩酸塩
|
| JAPIC | 添付文書(PDF) |
添付文書情報2024年1月 改訂(第1版)

|
2.禁忌 4.効能または効果 6.用法及び用量 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| テラルビシン注射用10mg | THERARUBICIN FOR INJECTION | Meiji Seikaファルマ | 4235403D1042 | 3679円/瓶 | 劇薬, 処方箋医薬品注) |
| テラルビシン注射用20mg | THERARUBICIN FOR INJECTION | Meiji Seikaファルマ | 4235403D2049 | 7754円/瓶 | 劇薬, 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
2.1 心機能異常又はその既往歴のある患者[心筋障害があらわれることがある。]
2.2 本剤に対し重篤な過敏症の既往歴のある患者
2.3 他のアントラサイクリン系薬剤等心毒性を有する薬剤による前治療が限界量(ドキソルビシン塩酸塩では総投与量が体表面積当り500mg/m2、ダウノルビシン塩酸塩では総投与量が体重当り25mg/kg等)に達している患者[心筋障害があらわれることがある。][9.1.4参照]
4. 効能または効果
6. 用法及び用量
(1)注射液の調製
本剤のバイアルに5%ブドウ糖注射液、注射用水又は生理食塩液10mLを加えて溶解する。
(2)投与方法
<静脈内注射の場合>
頭頸部癌はIII法又はIV法を、乳癌及び胃癌はI法又はIII法を、卵巣癌及び子宮癌はI法を、尿路上皮癌はI法又はII法を、急性白血病はV法を、悪性リンパ腫はI法又はIV法を標準的用法・用量として選択する。
I法(3〜4週1回法)
ピラルビシンとして、1日1回、40〜60mg(25〜40mg/m2)(力価)を投与し、3〜4週間休薬する。これを1クールとし、投与を繰り返す。
II法(3〜4週2回法)
ピラルビシンとして、1日1回、30〜40mg(20〜25mg/m2)(力価)を2日間連日投与し、3〜4週間休薬する。これを1クールとし、投与を繰り返す。
III法(週1回法)
ピラルビシンとして、1日1回、20〜40mg(14〜25mg/m2)(力価)を1週間間隔で2〜3回投与し、3〜4週間休薬する。これを1クールとし、投与を繰り返す。
IV法(連日法)
ピラルビシンとして、1日1回、10〜20mg(7〜14mg/m2)(力価)を3〜5日間連日投与し、3〜4週間休薬する。これを1クールとし、投与を繰り返す。
V法(連日法)
ピラルビシンとして、1日1回、10〜30mg(7〜20mg/m2)(力価)を5日間連日投与する。骨髄機能が回復するまで休薬し、投与を繰り返す。
<動脈内注射による頭頸部癌、膀胱癌の場合>
ピラルビシンとして、1日1回、10〜20mg(7〜14mg/m2)(力価)を連日又は隔日に5〜10回投与する。
<膀胱内注入による膀胱癌の場合>
カテーテルを用いて導尿した後、ピラルビシンとして、1日1回、15〜30mg(力価)を500〜1000μg(力価)/mLの溶液として週3回、各1〜2時間膀胱内把持する。これを1クールとし、2〜3クール繰り返す。
なお、年齢、症状により適宜増減する。
8. 重要な基本的注意
<効能共通>
8.1 骨髄機能抑制、心筋障害等の重篤な副作用が起こることがあるので、頻回に臨床検査(血液検査、肝機能・腎機能検査、心機能検査等)を行うなど、患者の状態を十分に観察すること。また、使用が長期間にわたると副作用が強くあらわれ、遷延性に推移することがあるので、投与は慎重に行うこと。
心機能検査としては、心電図等を原則としてクール(通常3〜4週)ごとに実施することが望ましい。[9.1.1、9.1.2、11.1.1、11.1.2参照]
心機能検査としては、心電図等を原則としてクール(通常3〜4週)ごとに実施することが望ましい。[9.1.1、9.1.2、11.1.1、11.1.2参照]
8.2 アントラサイクリン系薬剤未治療例で、本剤の総投与量が950mg/m2(体表面積)を超えると、うっ血性心不全を起こすことが多くなるので十分に注意すること。[11.1.1参照]
8.3 前治療等により950mg/m2以下の総投与量でもうっ血性心不全が起こることがあるので、他のアントラサイクリン系薬剤等心毒性を有する薬剤による前治療歴のある患者、心臓部あるいは縦隔に放射線療法を受けた患者及び本剤の総投与量が700mg/m2を超える患者では心機能検査を行い慎重に投与すること。[9.1.4、11.1.1参照]
8.4 感染症、出血傾向の発現又は増悪に十分注意すること。[9.1.2参照]
<急性白血病>
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 骨髄機能抑制のある患者
9.1.2 感染症を合併している患者
9.1.3 水痘患者
致命的な全身障害があらわれるおそれがある。
9.2 腎機能障害患者
副作用が強くあらわれるおそれがある。
9.3 肝機能障害患者
副作用が強くあらわれるおそれがある。
9.4 生殖能を有する者
9.4.2 男性には、本剤投与中及び最終投与後3ヵ月間においてバリア法(コンドーム)を用いて避妊する必要性について説明すること。[15.2.2参照]
9.4.3 小児及び生殖可能な年齢の患者に投与する必要がある場合には、性腺に対する影響を考慮すること。
9.5 妊婦
9.6 授乳婦
授乳しないことが望ましい。本剤は動物実験(ラット)の結果2)から乳汁に移行する可能性があり、乳児が乳汁を介して本剤を摂取した場合、乳児に重篤な副作用が発現するおそれがある。
9.7 小児等
副作用の発現に特に注意し、慎重に投与すること。小児等を対象とした臨床試験は実施していない。
9.8 高齢者
用量に留意して患者の状態を観察しながら慎重に投与すること。本剤は主として肝臓で代謝されるが、高齢者では肝機能等の生理機能が低下していることが多い。
10. 相互作用
10.2 併用注意
| 投与前の心臓部あるいは縦隔への放射線照射 潜在的に心毒性を有する他の抗悪性腫瘍剤 アントラサイクリン系薬剤等 | 心筋障害が増強されるおそれがある。 | 心筋に対する蓄積毒性が増強される。 |
| 他の抗悪性腫瘍剤 放射線照射 | 骨髄機能抑制等の副作用が増強することがある。 | 副作用が相互に増強される。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 心筋障害(頻度不明)
11.1.2 骨髄抑制
11.1.3 ショック(頻度不明)
11.1.4 間質性肺炎(頻度不明)
発熱、咳嗽、呼吸困難、胸部X線像異常等を伴う間質性肺炎があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
11.1.5 萎縮膀胱(4.0%)注)
膀胱内注入療法によって萎縮膀胱があらわれることがある。
注)膀胱内注入療法時の発現頻度。
11.2 その他の副作用
| 5%以上 | 0.1〜5%未満 | 頻度不明 | |
| 心臓 | 心電図異常 | 頻脈、不整脈 | |
| 肝臓 | 肝障害 | γ-GTP上昇 | AST、ALT、Al-P、LDH、総ビリルビン上昇 |
| 腎臓 | 腎障害、蛋白尿、BUN上昇、クレアチニン上昇 | ||
| 消化器 | 食欲不振(35.1%)、悪心・嘔吐、口内炎 | 下痢、腹痛、イレウス | 消化管出血、便秘 |
| 皮膚 | 脱毛 | 色素沈着 | |
| 精神神経系 | 全身倦怠(19.0%) | 頭痛、めまい、しびれ | |
| 泌尿器 | 排尿痛、血尿 | ||
| 泌尿器 (膀胱内注入療法時)注) | 頻尿(50.0%)、排尿痛(38.0%)、血尿等の膀胱刺激症状 | 排尿障害 | |
| 過敏症 | 発疹等の過敏症状 | 皮膚炎 | |
| その他 | 発熱 | 胸痛、動悸、息切れ、味覚異常 | 感染症、浮腫、血清総蛋白減少、電解質異常、顔面潮紅、耳鳴 |
14. 適用上の注意
14.1 薬剤調製時の注意
14.1.1 本剤は溶解時のpHにより力価の低下及び濁りを生じることがあるので、他の薬剤との混注を避け、日局ブドウ糖注射液、日局注射用水又は日局生理食塩液等に溶解して投与すること。pH6付近が最も安定であり、酸性側(pH5以下)及びアルカリ性側(pH8以上)で経時的に力価が低下する。
14.1.2 用時溶解注射剤のため、溶解後はできるだけ速やかに使用すること。
なお、やむを得ず保存を必要とする場合には、室温保存では6時間以内に使用すること。
なお、やむを得ず保存を必要とする場合には、室温保存では6時間以内に使用すること。
14.2 薬剤投与時の注意
14.2.1 皮下・筋肉内には投与しないこと。
14.2.2 膀胱癌の動脈内投与療法に際し阻血を行った症例で、高濃度の薬剤が坐骨神経に流れ、坐骨神経麻痺を起こしたとの報告があるので、このような投与方法を行う場合には慎重に投与すること。
14.2.3 血管内投与により、ときに血管痛、静脈炎等を起こすことがあるので、注射部位、注射方法等に十分注意すること。
14.2.4 血管内投与に際し、薬液が血管外に漏れると注射部位に硬結・壊死、炎症を起こすことがあるので、薬液が血管外に漏れないよう慎重に投与すること。
14.2.5 本剤を溶解した液とシリンジに塗布されているシリコンオイルが接触することで、シリンジ内にまれにシリコンオイルの浮遊物がみられることがある。その場合はフィルターを使用して投与すること。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 本剤と他の抗悪性腫瘍剤を併用した患者に、急性白血病(前白血病相を伴う場合もある)、骨髄異形成症候群(MDS)が発生したとの報告がある。
15.1.2 本剤の尿中排泄により尿が赤色になることがある。
15.2 非臨床試験に基づく情報
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
(1)静脈内投与
癌患者に本剤30mg/m2をワンショット静注投与した場合、投与1分後の血漿中濃度は0.52±0.28μg/mLで、投与後急速に低下したが、8時間以上にわたり6〜11ng/mLの濃度が持続した。α、β、γ相の血漿中濃度半減期はそれぞれ0.89分、0.46時間、14.2時間であった3)。
図 癌患者における血漿中濃度
(2)膀胱内投与
癌患者4名に本剤20mg(0.5mg/mL)を膀胱内に単回投与した症例において、血中には本剤はほとんど検出されなかった。
16.3 分布
16.3.1 蛋白結合
限外濾過法により測定したヒト血清蛋白との結合率は本剤の濃度10、25、50及び100μg/mLで、それぞれ76.2、33.9、38.3及び19.0%であった(in vitro)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第II相試験(静脈内投与)
17.1.2 国内第II相試験(動脈内投与)
17.1.3 国内第II相試験(膀胱内注入)
表在性膀胱癌に対する有効率は、60.0%(30/50)であった6)。
18. 薬効薬理
18.1 作用機序
18.2 抗腫瘍効果
19. 有効成分に関する理化学的知見
19.1. ピラルビシン
22. 包装
<テラルビシン注射用10mg>
1バイアル
<テラルビシン注射用20mg>
1バイアル
23. 主要文献
- 暮部 勝ほか, Jpn. J. Antibiot., 39 (2), 477-506, (1986) »PubMed
- 刀根 弘ほか, Jpn. J. Antibiot., 39 (2), 612-628, (1986) »PubMed
- 藤原 潔, 慶應医学, 65 (2), 147-162, (1988)
- 斉藤達雄ほか, 癌と化学療法, 13 (4), 1060-1069, (1986)
- 中尾 功ほか, 癌と化学療法, 18 (8), 1325-1332, (1991) »PubMed
- 新島端夫ほか, 癌と化学療法, 13 (2), 224-231, (1986) »PubMed
- 木村禧代二ほか, 癌と化学療法, 13 (2), 368-375, (1986) »PubMed
- 竹田千里ほか, 癌と化学療法, 13 (5), 1970-1979, (1986) »PubMed
- 阿部令彦ほか, 癌と化学療法, 13 (6), 2160-2168, (1986) »PubMed
- Kunimoto, S., et al., J. Antibiot., 36 (3), 312-317, (1983) »PubMed
- Tanaka, M., et al., Jpn. J. Cancer Res.(Gann), 74 (6), 829-836, (1983)
- 高本 滋ほか, 癌と化学療法, 13 (5), 1868-1875, (1986) »PubMed
- Umezawa, H., et al., J. Antibiot., 32 (10), 1082-1084, (1979) »PubMed
- Tsuruo, T., et al., Cancer Res., 42 (4), 1462-1467, (1982) »PubMed
- Hisamatsu, T., et al., Jpn. J. Cancer Res.(Gann), 76 (10), 1008-1020, (1985) »PubMed
- Matsushita, Y., et al., J. Antibiot., 38 (10), 1408-1419, (1985) »PubMed
24. 文献請求先及び問い合わせ先
文献請求先
Meiji Seikaファルマ株式会社
くすり相談室
〒104-8002
東京都中央区京橋2-4-16
電話:フリーダイヤル 0120-093-396
03-3273-3539
03-3273-3539
FAX:03-3272-2438
製品情報問い合わせ先
Meiji Seikaファルマ株式会社
くすり相談室
〒104-8002
東京都中央区京橋2-4-16
電話:フリーダイヤル 0120-093-396
03-3273-3539
03-3273-3539
FAX:03-3272-2438
26. 製造販売業者等
26.1 製造販売元
Meiji Seikaファルマ株式会社
東京都中央区京橋2-4-16