医薬品情報
| 総称名 | コルヒチン |
|---|---|
| 一般名 | コルヒチン |
| 欧文一般名 | Colchicine |
| 製剤名 | コルヒチン錠 |
| 薬効分類名 | 痛風・家族性地中海熱治療剤 |
| 薬効分類番号 | 3941 |
| ATCコード | M04AC01 |
| KEGG DRUG |
D00570
コルヒチン
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年6月 改訂(第1版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| コルヒチン錠0.5mg「タカタ」 | COLCHICINE Tablets"TAKATA" | 高田製薬 | 3941001F1077 | 9.6円/錠 | 劇薬, 処方箋医薬品 |
2. 禁忌
次の患者には投与しないこと
4. 効能または効果
6. 用法及び用量
<痛風発作の緩解及び予防>
通常、成人にはコルヒチンとして1日3〜4mgを6〜8回に分割経口投与する。
なお、年齢、症状により適宜増減する。
発病予防には通常、成人にはコルヒチンとして1日0.5〜1mg、発作予感時には1回0.5mgを経口投与する。
なお、年齢、症状により適宜増減する。
発病予防には通常、成人にはコルヒチンとして1日0.5〜1mg、発作予感時には1回0.5mgを経口投与する。
<家族性地中海熱>
通常、成人にはコルヒチンとして1日0.5mgを1回又は2回に分けて経口投与する。
なお、患者の状態により適宜増減するが、1日最大投与量は1.5mgまでとする。
なお、患者の状態により適宜増減するが、1日最大投与量は1.5mgまでとする。
通常、小児にはコルヒチンとして1日0.01〜0.02mg/kgを1回又は2回に分けて経口投与する。
なお、患者の状態により適宜増減するが、1日最大投与量は0.03mg/kgまでとし、かつ成人の1日最大投与量を超えないこととする。
なお、患者の状態により適宜増減するが、1日最大投与量は0.03mg/kgまでとし、かつ成人の1日最大投与量を超えないこととする。
7. 用法及び用量に関連する注意
<痛風発作の緩解及び予防>
7.1 痛風発作の発現後、服用開始が早いほど効果的である。
7.2 大量使用又は誤用により、服用後数時間以内に急性中毒症状があらわれることがあるので、用法及び用量を厳守し、次の事項に注意すること。[13.1、15.1.1参照]
・痛風発作の治療には1回0.5mgを投与し、疼痛発作が緩解するまで3〜4時間ごとに投与する。投与量の増加に伴い、下痢等の胃腸障害の発現が増加するため、1日量は1.8mgまでの投与にとどめることが望ましい。
・発作3〜4時間前に先行する予兆を感知したらできるだけ早く服用することが望ましい。
7.3 長期間にわたる痛風発作の予防的投与は、血液障害、生殖器障害、肝・腎障害、脱毛等重篤な副作用発現の可能性があり、有用性が少なくすすめられない。
8. 重要な基本的注意
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 衰弱の著しい患者(特に腎疾患、胃腸疾患、心疾患を有する患者)
腎疾患、胃腸疾患、心疾患を悪化させるおそれがある。
9.2 腎機能障害患者
9.2.1 肝代謝酵素CYP3A4を強く阻害する薬剤又はP糖蛋白を阻害する薬剤を服用中の腎機能障害患者
9.2.2 9.2.1に述べた併用薬を服用していない腎機能障害患者
9.3 肝機能障害患者
9.3.1 肝代謝酵素CYP3A4を強く阻害する薬剤又はP糖蛋白を阻害する薬剤を服用中の肝機能障害患者
9.3.2 9.3.1に述べた併用薬を服用していない肝機能障害患者
投与する場合には、ごく少量から開始すること。本剤の血漿中濃度が上昇し、早期に重篤な副作用があらわれるおそれがある。[16.1.4参照]
9.5 妊婦
<痛風発作の緩解及び予防>
<家族性地中海熱>
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。[16.6.2参照]
9.7 小児等
<痛風発作の緩解及び予防>
9.7.1 小児等を対象とした臨床試験は実施していない。
<家族性地中海熱>
9.7.2 家族性地中海熱では、2歳未満の小児に投与した事例は報告されていない。
9.8 高齢者
用量並びに投与間隔に留意するなど患者の状態を観察しながら、慎重に投与すること。高齢者を対象とした薬物動態試験で、高い血中濃度が持続する傾向が認められている。[16.1.2参照]
10. 相互作用
相互作用序文
本剤は主として肝代謝酵素CYP3A4によって代謝され、P糖蛋白の基質でもある。
薬物代謝酵素用語
CYP3A4
薬物代謝酵素用語
P糖蛋白
10.2 併用注意
| 肝代謝酵素CYP3A4を阻害する薬剤等[2.2、9.2.1、9.3.1参照] 強く阻害する薬剤 アタザナビル、 クラリスロマイシン、 イトラコナゾール、 リトナビルを含有する製剤、 ダルナビルを含有する製剤、 コビシスタットを含有する製剤、 エンシトレルビル 中等度阻害する薬剤 アプレピタント、 ジルチアゼム、 エリスロマイシン、 フルコナゾール、 ホスアンプレナビル、 ベラパミル グレープフルーツジュース | 本剤の作用が増強することがある。併用する場合は減量あるいは低用量から開始するなど注意すること。 なお、肝臓又は腎臓に障害のある患者には肝代謝酵素CYP3A4を強く阻害する薬剤は投与しないこと。 | 肝代謝酵素CYP3A4を阻害することにより本剤の血中濃度を上昇させることがある。 |
| P糖蛋白を阻害する薬剤[2.2、9.2.1、9.3.1参照] シクロスポリン | 本剤の作用が増強することがある。併用する場合は減量あるいは低用量から開始するなど注意すること。 なお、肝臓又は腎臓に障害のある患者には投与しないこと。 | P糖蛋白の活性を阻害することにより本剤の血中濃度を上昇させることがある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 再生不良性貧血、顆粒球減少、白血球減少、血小板減少(頻度不明)[8.参照]
11.1.2 横紋筋融解症、ミオパチー(頻度不明)
筋肉痛、脱力感、CK上昇、血中及び尿中ミオグロビン上昇等を特徴とする横紋筋融解症があらわれ、これに伴って急性腎障害等の重篤な腎障害があらわれることがある。また、筋肉痛、筋力低下、CK上昇等を伴うミオパチーがあらわれることがある。[8.参照]
11.1.3 末梢神経障害(頻度不明)[8.参照]
11.2 その他の副作用
| 頻度不明 | |
| 過敏症 | 全身のそう痒、発疹、発熱 |
| 消化器 | 下痢、悪心・嘔吐、腹痛、腹部疝痛 |
| 腎臓 | BUN上昇、クレアチニン上昇、尿蛋白陽性、血尿、乏尿 |
| 肝臓 | 肝機能異常(AST上昇、ALT上昇、γ-GTP上昇)、Al-P上昇 |
| その他 | 脱力感、脱毛 |
13. 過量投与
13.1 症状
急性中毒症状として服用後数時間以内に次のような症状があらわれることがある。[7.2参照]
悪心・嘔吐、腹部痛、激烈な下痢、咽頭部・胃・皮膚の灼熱感、血管障害、ショック、血尿、乏尿、著明な筋脱力、中枢神経系の上行性麻痺、譫妄、痙攣、呼吸抑制による死亡
悪心・嘔吐、腹部痛、激烈な下痢、咽頭部・胃・皮膚の灼熱感、血管障害、ショック、血尿、乏尿、著明な筋脱力、中枢神経系の上行性麻痺、譫妄、痙攣、呼吸抑制による死亡
13.2 処置
副作用発現までには3〜6時間の潜伏期があるので、服用後、間がないとき(6時間以内)には胃洗浄、吸引を行う。活性炭の投与も有効である。水・電解質異常の補正には中心静脈圧をモニターしながら輸液、カリウムの投与を行い、凝固因子の欠乏に対しては、ビタミンK、新鮮凍結血漿等の投与、急性呼吸不全には気道を確保し、酸素吸入を行う。その他出血、感染、疼痛等には対症療法を行う。
本剤は強制利尿や腹膜透析、血液透析では除去されない。
本剤は強制利尿や腹膜透析、血液透析では除去されない。
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔を起こして縦隔洞炎等の重篤な合併症を併発することが報告されている。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 海外の臨床試験において、コルヒチン低用量(1.8mg/日)群と高用量(4.8mg/日)群の疼痛発作に関する有効性を比較したところ、両群に差がなかった。また高用量群の方が下痢等の胃腸系有害事象の発現は高かった6)。[7.2参照]
15.1.2 父親が本剤を服用した場合、その配偶者より、ダウン症候群及びその他の先天異常児が出生する可能性があるとの報告がある7)。
15.2 非臨床試験に基づく情報
ラットにおいて精巣毒性(精上皮細胞の脱落等)を引き起こすことが報告されている8)。
16. 薬物動態
16.1 血中濃度
16.1.1 健康成人9)(外国人データ)
| 投与量(mg) | n | Cmax(ng/mL) | Tmax(hr) | AUC0-48(ng・hr/mL) |
| 1 | 6 | 5.64±1.37 | 1.01±0.56 | 47.9±12.2 |
16.1.2 高齢者
16.1.3 腎障害患者
16.1.4 肝障害患者
16.2 吸収
生物学的利用率(mean±S.D.):37±12%9)
16.3 分布
分布容積(Vd/F)4.87L/kg11):1mg単回経口投与(外国人データ)
16.4 代謝
消化管より吸収された後、一部は肝臓で脱アセチル化を受ける。大部分の未変化体と代謝物は腸肝循環する。
16.5 排泄
16.5.1 部位:胆汁中及び尿中
16.6 特定の背景を有する患者
16.6.1 妊婦への投与
胎盤通過性:胎盤を通過し、新生児の臍帯血からも検出された13)(外国人データ)。
16.6.2 授乳婦への投与時のデータ
16.6.3 腎不全患者への投与時のデータ
血液透析:透析されない15)(外国人データ)。
16.8 その他
16.8.1 作用持続時間:3〜4時間
18. 薬効薬理
18.1 作用機序
コルヒチンは微小管タンパク質(チューブリン)に結合することにより顆粒球(主として好中球)及びその他の運動性細胞の繊維性微小管の収縮(脱重合)と消滅を起こし、炎症域への顆粒球の遊走阻害と顆粒球の代謝活性、食活性の減少を起こす。その結果、尿酸結晶の貪食により惹起される乳酸や炎症前期の酵素の遊離を抑制し、炎症反応が抑制される。
コルヒチンは肥満細胞からのヒスタミン含有顆粒遊離を抑制する。
コルヒチンは細胞の有糸核分裂抑制作用を有するが、この作用は痛風発作の抑制作用と無関係であり、またこの作用に基づく抗悪性腫瘍効果は少ないとされる16)。
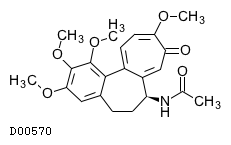
19. 有効成分に関する理化学的知見
19.1. コルヒチン
20. 取扱い上の注意
外箱開封後は、遮光して保存すること。
22. 包装
100錠[10錠(PTP)×10]
23. 主要文献
- Ingalls,T.H,et al., Arch.Environ.Health., 16, 326-332, (1968) »PubMed
- Ben-Chetrit,E,et al., Arthritis.Care Res., 62 (2), 143-148, (2010)
- Diav-Citrin,O,et al., Am.J.Obstet.Gynecol., 203 (144), e1-e6, (2010)
- Rabinovitch,O,et al., Am.J.Reprod.Immunol., 28, 245-246, (1992) »PubMed
- Berkenstadt,M,et al., Am.J.Obstet.Gynecol., 193, 1513-1516, (2005) »PubMed
- Terkeltaub,R.A,et al., Arthritis Rheum., 62 (4), 1060-1068, (2010) »PubMed
- 吉田篤他, 眼科, 27 (11), 1359-1361, (1985)
- Correa.,L.M,et al., Toxicolobical.Scienses., 69, 175-182, (2002)
- Ferron,G.M,et al., J.Clin.Pharmacol., 36, 874-883, (1996) »PubMed
- Rochdi,M,et al., Eur.J.Clin.Pharmacol., 46, 351-354, (1994) »PubMed
- Ben-Chetrit,E,et al., J.Rheumatol., 21 (4), 710-713, (1994) »PubMed
- Rudi,J,et al., Scand.J.Gastroenterol., 29, 346-351, (1994) »PubMed
- Amoura,Z,et al., J.Rheumatol., 21, 383, (1994) »PubMed
- Ben-Chetrit,E,et al., Arthritis Rheum., 39 (7), 1213-1217, (1996) »PubMed
- Heaney,D,et al., Am.J.Med.Sci., 271 (2), 233-238, (1976) »PubMed
- 日本薬局方解説書編集委員会編, 第十八改正 日本薬局方解説書, C-2013-2019, (2021)
24. 文献請求先及び問い合わせ先
文献請求先
高田製薬株式会社
文献請求窓口
〒336-8666
さいたま市南区沼影1丁目11番1号
電話:0120-989-813
FAX:048-816-4183
製品情報問い合わせ先
高田製薬株式会社
文献請求窓口
〒336-8666
さいたま市南区沼影1丁目11番1号
電話:0120-989-813
FAX:048-816-4183
26. 製造販売業者等
26.1 製造販売元(輸入)
高田製薬株式会社
さいたま市西区宮前町203番地1