医薬品情報
| 総称名 | ジスロマック |
|---|---|
| 一般名 | アジスロマイシン水和物 |
| 欧文一般名 | Azithromycin Hydrate |
| 製剤名 | 点滴静注用アジスロマイシン水和物 |
| 薬効分類名 | 15員環マクロライド系抗生物質製剤 |
| 薬効分類番号 | 6149 |
| ATCコード | J01FA10 |
| KEGG DRUG |
D02134
アジスロマイシン水和物
|
| KEGG DGROUP |
DG01551
マクロライド系抗生物質
|
| JAPIC | 添付文書(PDF) |
添付文書情報2022年6月 改訂(第1版)

|
2.禁忌 4.効能または効果 6.用法及び用量 7.用法及び用量に関連する注意 8.重要な基本的注意 9.特定の背景を有する患者に関する注意 10.相互作用 11.副作用 13.過量投与 14.適用上の注意 15.その他の注意 16.薬物動態 17.臨床成績 18.薬効薬理 19.有効成分に関する理化学的知見 22.包装 23.主要文献 24.文献請求先及び問い合わせ先 26.製造販売業者等 |
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ジスロマック点滴静注用500mg | ZITHROMAC Intravenous use | ファイザー | 6149400D1021 | 1863円/瓶 | 処方箋医薬品注) |
2. 禁忌
次の患者には投与しないこと
本剤の成分に対し過敏症の既往歴のある患者
4. 効能または効果
<適応菌種>
<適応症>
肺炎、骨盤内炎症性疾患
6. 用法及び用量
成人にはアジスロマイシンとして500mg(力価)を1日1回、2時間かけて点滴静注する。
7. 用法及び用量に関連する注意
<効能共通>
7.1 本剤の投与期間として5日間を超える投与経験は少ないことから、投与期間が5日を超える場合は、経過観察を十分行うこと。
<肺炎>
7.3 アジスロマイシン注射剤からアジスロマイシン錠に切り替えた臨床試験は、医師が経口投与可能と判断した時点で、アジスロマイシン注射剤からアジスロマイシン錠500mg(力価)を1日1回投与に切り替え、本剤の投与期間は2〜5日間、総投与期間は合計7〜10日間で実施され、総投与期間として10日間を超える投与経験は少ない。[17.1.1参照]
<骨盤内炎症性疾患>
7.4 アジスロマイシン注射剤からアジスロマイシン錠に切り替えた臨床試験は、医師が経口投与可能と判断した時点で、アジスロマイシン注射剤からアジスロマイシン錠250mg(力価)を1日1回投与に切り替え、本剤の投与期間は1〜2日間、総投与期間は合計7日間で実施され、総投与期間として7日間を超える投与経験はない。[17.1.3参照]
8. 重要な基本的注意
8.1 本剤の使用にあたっては、耐性菌の発現等を防ぐため、原則として感受性を確認し、疾病の治療上必要な最小限の期間の投与にとどめること。
8.2 アナフィラキシー・ショックがあらわれるおそれがあるので、アレルギー既往歴、薬物過敏症等について十分な問診を行うこと。[11.1.1参照]
8.3 本剤の使用にあたっては、事前に患者に対して、次の点を指導すること。[11.1.2参照]
・中毒性表皮壊死融解症、皮膚粘膜眼症候群が疑われる症状[発疹に加え、粘膜(口唇、眼、外陰部)のびらんあるいは水ぶくれ等の症状]があらわれた場合には、ただちに医師に連絡すること。
・投与終了後においても上記症状があらわれることがあるので、症状があらわれた場合にはただちに医師に連絡すること。
8.4 意識障害等があらわれることがあるので、自動車の運転等、危険を伴う機械の操作に従事する際には注意するよう患者に十分に説明すること。
8.5 アジスロマイシンは組織内半減期が長いことから、投与終了数日後においても副作用が発現する可能性があるので、観察を十分に行うなど注意すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 他のマクロライド系又はケトライド系薬剤に対し過敏症の既往歴のある患者
9.1.2 心疾患のある患者
QT延長、心室性頻脈(Torsade de pointesを含む)を起こすことがある。[11.1.8参照]
9.3 肝機能障害患者
9.3.1 高度な肝機能障害のある患者
投与量並びに投与間隔に留意するなど慎重に投与すること。肝機能を悪化させるおそれがある。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
9.6 授乳婦
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
患者の一般状態に注意して投与すること。アジスロマイシン経口剤の一般感染症の臨床試験成績から、高齢者において認められた副作用の種類及び副作用発現率は、非高齢者と同様であったが、一般に高齢者では、生理機能が低下しており、血中・組織内濃度が高くなることがある。
10. 相互作用
10.2 併用注意
| ワルファリン | 国際標準化プロトロンビン比上昇の報告がある4)5)。 | マクロライド系薬剤はワルファリンの肝臓における主たる代謝酵素であるチトクロームP450を阻害するので、ワルファリンの作用が増強することがあるが、アジスロマイシンでの機序の詳細は明らかではない。 |
| シクロスポリン | シクロスポリンの最高血中濃度の上昇及び血中濃度半減期の延長の報告がある6)。 | マクロライド系薬剤はシクロスポリンの主たる代謝酵素であるチトクロームP450を阻害するので、シクロスポリンの血中濃度が上昇することがあるが、アジスロマイシンでの機序の詳細は明らかではない。 |
| ネルフィナビル | アジスロマイシン錠の1200mg投与で、アジスロマイシンの濃度・時間曲線下面積(AUC)及び平均最高血中濃度の上昇の報告がある7)。 | 機序不明 |
| ジゴキシン | アジスロマイシンとの併用により、ジゴキシン中毒の発現リスク上昇の報告がある8)。 | P-糖蛋白質を介したジゴキシンの輸送が阻害されることにより、ジゴキシンの血中濃度が上昇することを示唆した報告があるが、アジスロマイシンでの機序の詳細は明らかではない。 |
| ベネトクラクス | ベネトクラクスの効果が減弱するおそれがあるので、併用を避けることが望ましい。 | 機序は不明であるが、ベネトクラクスの血中濃度が低下する可能性がある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック(頻度不明)、アナフィラキシー(頻度不明)
呼吸困難、喘鳴、血管浮腫等を起こすことがある。また、アジスロマイシンは組織内半減期が長いことから、これらの副作用の治療中止後に再発する可能性があるので注意すること。[8.2参照]
11.1.2 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)(頻度不明)、皮膚粘膜眼症候群(Stevens-Johnson症候群)(頻度不明)、急性汎発性発疹性膿疱症(頻度不明)
異常が認められた場合には投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。これらの副作用はアジスロマイシンの投与中又は投与終了後1週間以内に発現しているので、投与終了後も注意すること。また、アジスロマイシンは組織内半減期が長いことから、これらの副作用の治療中止後に再発する可能性があるので注意すること。[8.3参照]
11.1.3 薬剤性過敏症症候群(頻度不明)
初期症状として発疹、発熱がみられ、更に肝機能障害、リンパ節腫脹、白血球増加、好酸球増多、異型リンパ球出現等を伴う遅発性の重篤な過敏症状があらわれることがある。なお、ヒトヘルペスウイルス6(HHV-6)等のウイルスの再活性化を伴うことが多く、投与中止後も発疹、発熱、肝機能障害等の症状が再燃あるいは遷延化することがあるので注意すること9)。
11.1.4 肝炎(頻度不明)、肝機能障害(頻度不明)、黄疸(頻度不明)、肝不全(頻度不明)
11.1.5 急性腎障害(頻度不明)
乏尿等の症状や血中クレアチニン値上昇等の腎機能低下所見が認められた場合には、投与を中止し、適切な処置を行うこと。
11.1.6 偽膜性大腸炎(頻度不明)、出血性大腸炎(頻度不明)
偽膜性大腸炎、出血性大腸炎等の重篤な大腸炎があらわれることがあるので、腹痛、頻回の下痢、血便等があらわれた場合にはただちに投与を中止し、適切な処置を行うこと。
11.1.7 間質性肺炎(頻度不明)、好酸球性肺炎(頻度不明)
発熱、咳嗽、呼吸困難、胸部X線異常、好酸球増多等を伴う間質性肺炎、好酸球性肺炎があらわれることがあるので、このような症状があらわれた場合には投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
11.1.8 QT延長(頻度不明)、心室性頻脈(Torsade de pointesを含む)(頻度不明)
QT延長等の心疾患のある患者には特に注意すること。[9.1.2参照]
11.1.9 白血球減少(頻度不明)、顆粒球減少(頻度不明)、血小板減少(頻度不明)
11.1.10 横紋筋融解症(頻度不明)
筋肉痛、脱力感、CK上昇、血中及び尿中ミオグロビン上昇等があらわれた場合には、投与を中止し、適切な処置を行うこと。また、横紋筋融解症による急性腎障害の発症に注意すること。
11.2 その他の副作用
| 1%以上a) | 0.1〜1%未満a) | 0.1%未満a) | 頻度不明 | |
| 皮膚 | 発疹、蕁麻疹、そう痒症 | アトピー性皮膚炎増悪 | 光線過敏性反応、紅斑、水疱、皮膚剥離、多形紅斑、寝汗、多汗症、皮膚乾燥、皮膚変色、脱毛 | |
| 血液 | 好酸球数増加 | 白血球数減少 | 血小板数増加、好塩基球数増加、顆粒球数減少、プロトロンビン時間延長、血小板数減少 | 貧血、リンパ球数減少、ヘモグロビン減少、白血球数増加 |
| 血管障害 | 血栓性静脈炎 | 潮紅 | ||
| 循環器 | 血圧低下、動悸、血圧上昇 | |||
| 肝臓 | ALT増加 | AST増加、ALP増加、γ-GTP増加、LDH増加、肝機能検査異常 | 血中ビリルビン増加 | |
| 腎臓 | BUN増加、尿中蛋白陽性 | クレアチニン増加、腎臓痛、排尿困難、尿潜血陽性、頻尿 | ||
| 消化器 | 下痢 | 腹痛、悪心、嘔吐、腹部不快感、腹部膨満 | 便秘、口内炎、消化不良、食欲不振、鼓腸放屁、口唇のあれ、黒毛舌、舌炎、舌苔、腹鳴 | 舌変色、口・舌のしびれ感、おくび、胃炎、口内乾燥、唾液増加、膵炎、アフタ性口内炎、口腔内不快感、消化管障害、口唇炎 |
| 精神・神経系 | 頭痛、めまい、灼熱感、傾眠、味覚異常、感覚鈍麻、不眠症 | 失神、痙攣、振戦、激越、嗅覚異常、無嗅覚、神経過敏、不安、錯感覚、攻撃性 | ||
| 感染症 | カンジダ症 | 胃腸炎 | 真菌感染、咽頭炎、皮膚感染、肺炎、β溶血性レンサ球菌感染、膣炎 | |
| 眼 | 結膜炎、眼瞼浮腫、霧視、ぶどう膜炎、眼痛、視力障害 | |||
| 筋骨格系 | 筋肉痛、関節痛、頚部痛、背部痛、四肢痛、関節腫脹 | |||
| 呼吸器 | 咳嗽、呼吸困難、嗄声 | 鼻出血、アレルギー性鼻炎、くしゃみ、ラ音、気管障害、低音性連続性ラ音、鼻部障害、鼻閉、鼻漏、羊鳴性気管支音、痰貯留 | ||
| 耳 | 耳痛、難聴、耳鳴、聴力低下、耳の障害 | |||
| 生殖器 | 卵巣嚢腫 | 精巣痛、不正子宮出血 | ||
| 代謝 | 血中カリウム減少、血中カリウム増加 | 脱水、血中重炭酸塩減少、低カリウム血症 | ||
| 注入部位 | 疼痛 | 血管外漏出、紅斑 | ||
| その他 | 発熱、口渇、気分不良、倦怠感、浮遊感 | 胸痛、無力症、浮腫、低体温、不整脈、咽喉頭異物感、局所腫脹、粘膜異常感覚、疼痛、疲労 |
13. 過量投与
13.1 症状
本剤の過量投与により聴力障害を起こす可能性がある。
14. 適用上の注意
14.1 薬剤調製時の注意
14.1.1 本剤を注射用水4.8mLに溶解した液(濃度100mg/mL)を、5%ブドウ糖注射液等の配合変化がないことが確認されている輸液を用いて注射溶液濃度1.0mg/mLに希釈する。
100mg/mL溶液を調製の際には、注射用水以外での調製データはないことから、注射用水以外の溶液を使用しないこと。
国内第I相試験で、注射液濃度が2.0mg/mLの場合、注射部位疼痛の発現頻度が上昇したため、1.0mg/mLを超える投与は原則として行わないこと。また、外国第I相試験で注射液濃度が2.0mg/mLを超えた場合、注射部位疼痛及び注射部位反応の発現頻度が上昇するとの報告がある。
本剤の使用にあたっては、完全に溶解したことを確認すること。
100mg/mL溶液を調製の際には、注射用水以外での調製データはないことから、注射用水以外の溶液を使用しないこと。
国内第I相試験で、注射液濃度が2.0mg/mLの場合、注射部位疼痛の発現頻度が上昇したため、1.0mg/mLを超える投与は原則として行わないこと。また、外国第I相試験で注射液濃度が2.0mg/mLを超えた場合、注射部位疼痛及び注射部位反応の発現頻度が上昇するとの報告がある。
本剤の使用にあたっては、完全に溶解したことを確認すること。
14.1.2 本瓶は内容が減圧になっているので、容易に注射用水を注入することができる。万一、通常の操作で溶解液が入らない場合は、外気が入っている可能性があるので使用しないこと。
14.1.3 溶解後は速やかに使用すること。
14.2 薬剤投与時の注意
本剤は、2時間かけて点滴静注すること。なお、急速静注(ボーラス)は行わないこと。
15. その他の注意
15.1 臨床使用に基づく情報
アジスロマイシンとの因果関係は不明だが、心悸亢進、間質性腎炎、肝壊死、運動亢進があらわれたとの報告がある。
15.2 非臨床試験に基づく情報
16. 薬物動態
16.1 血中濃度
健常成人男子各10例にアジスロマイシン注射剤500mgを、1mg/mLの濃度で3時間及び2時間かけて点滴静注し、単回及び1日1回、5日間反復投与したときの血清中濃度を図1に、単回投与後の薬物動態パラメータを表に示す。5日間反復投与したとき、単回投与時と比較して、Cmaxは約8〜12%上昇、AUC0-24は約1.5〜1.6倍に増加した17)。
図1 単回及び反復投与後の血清中濃度推移
(血清中濃度:平均値+標準偏差、n=10)
| 点滴時間 | n | Cmax(μg/mL) | t1/2(h) | AUC0-24(μg・h/mL) | AUC0-∞(μg・h/mL) |
| 3時間 | 10 | 1.53±0.36 | 65.2±14.9a) | 6.88±1.23 | 10.9±1.0a) |
| 2時間 | 10 | 1.99±0.36 | 89.7±43.2 | 7.02±1.41 | 13.2±3.0 |
16.3 分布
16.3.1 組織内濃度
16.3.2 アジスロマイシンはヒト多形核白血球及びマウスマクロファージ等の食細胞への良好な移行が認められた20)。
アジスロマイシンが移行した食細胞が感染組織に遊走することにより、感染組織では非感染組織に比べて高い薬剤濃度が得られることが動物(マウス)試験で認められている21)。
アジスロマイシンが移行した食細胞が感染組織に遊走することにより、感染組織では非感染組織に比べて高い薬剤濃度が得られることが動物(マウス)試験で認められている21)。
16.3.3 血清蛋白結合率
アジスロマイシンのヒト血清蛋白との結合率は12.2〜20.3%(in vivo、超遠心法)であった22)。
16.4 代謝
アジスロマイシンのチトクロームP450による代謝は確認されていない。
16.5 排泄
16.5.1 健常成人男子6名にアジスロマイシン錠500mg(力価)を単回経口投与したとき、投与後168時間までの尿中に未変化体として投与量の9%が排泄された23)。
健常成人男子の尿及び患者の胆汁中代謝物について検討した結果、いずれもほとんどは未変化体で、代謝物として脱メチル体、脱クラジノース体が確認された22)。アジスロマイシンは胆汁、消化管分泌を介して、未変化体としてほとんど糞中に排泄される。
健常成人男子の尿及び患者の胆汁中代謝物について検討した結果、いずれもほとんどは未変化体で、代謝物として脱メチル体、脱クラジノース体が確認された22)。アジスロマイシンは胆汁、消化管分泌を介して、未変化体としてほとんど糞中に排泄される。
16.5.2 ラットに14C-標識アジスロマイシン20mg/kgを単回経口投与したとき、投与後168時間までに投与量の80.3%が糞中に、13.3%が尿中に排泄され、また投与後72時間までに投与量の3.1%が呼気中に排泄された1)。
16.6 特定の背景を有する患者
16.6.1 肝機能障害患者
軽度及び中等度の肝機能障害患者(成人)16例にアジスロマイシンカプセル注)500mg(力価)を単回経口投与したとき、健常成人男子に比べて、Cmaxが増加し、t1/2が延長する傾向が認められたが、有意差は認められなかった。また尿中排泄率においても有意差は認められなかった24)(外国人データ)。
注)国内で承認されている成人用製剤は錠剤及び注射剤である。
16.6.2 腎機能障害患者
16.7 薬物相互作用
16.7.1 他のマクロライド系薬剤において、下記薬剤による相互作用が報告されている。
(1)テオフィリン、ミダゾラム、トリアゾラム、カルバマゼピン、フェニトイン
これらの薬剤の血中濃度が上昇し、作用が増強されるおそれがある。
(2)エルゴタミン含有製剤
四肢の虚血を起こすことがある。
16.7.2 他の抗菌剤との相互作用
アジスロマイシンと他の抗菌剤との相互作用に関しては、これまでの国内又は外国における臨床試験成績から、マクロライド系、ペニシリン系、キノロン系、テトラサイクリン系、セフェム系及びカルバペネム系抗菌剤との間で相互作用によると考えられる有害事象の報告はない。
17. 臨床成績
17.1 有効性及び安全性に関する試験
アジスロマイシン注射剤からアジスロマイシン経口剤へ切り替えた(スイッチ療法)場合の成績
<呼吸器感染症(肺炎)>
17.1.1 国内第III相試験
呼吸器感染症(肺炎)に対する非対照試験において、アジスロマイシン注射剤500mgを1日1回、2〜5日間点滴静注した後、アジスロマイシン錠500mg(力価)を1日1回経口投与した。注射剤と経口剤の総投与期間は合計7〜10日間とした。注射剤から経口剤への切り替えは、被験者の状態で医師が判断した。投与開始15日目の有効率は84.5%(60/71)であった。本試験で原因菌として分離同定された肺炎球菌はすべてアジスロマイシンに対する感受性は低かったが(MIC≧2μg/mL)、11例のうち10例が有効例であった。
| n/Na)有効率(%) | |
| 感受性別: | |
| 耐性(MIC≧2μg/mL) | 10/11(90.9) |
| MIC不明 | 2/3(66.7) |
| MIC別: | |
| MIC=4μg/mL | 1/1(100) |
| MIC=8μg/mL | 0/1(0) |
| MIC=16μg/mL | 3/3(100) |
| MIC>64μg/mL | 6/6(100) |
17.1.2 海外第III相試験
<骨盤内炎症性疾患>
17.1.3 国内第III相試験
骨盤内炎症性疾患を対象とした臨床試験(詳細診断名:肝周囲炎、骨盤腹膜炎、ダグラス窩膿瘍、子宮内感染、子宮付属器炎)では、アジスロマイシン注射剤500mgを1日1回、1〜2日間点滴静注した後、アジスロマイシン錠250mg(力価)を1日1回経口投与した。注射剤と経口剤の総投与期間は合計7日間とした。注射剤から経口剤への切り替えは、被験者の状態で医師が判断した。
投与開始15日目の有効率は94.1%(48/51)であった。主な原因菌であるクラミジア・トラコマティス及び淋菌に対する臨床効果(有効率)及び細菌学的効果(菌消失率)は、それぞれ、100%(12/12、6/6及び11/11、6/6)であった29)。
本試験で報告された主な副作用は下痢11.8%(9/76)、注射部位疼痛及び悪心各5.3%(4/76)であった29)。[7.2、7.4参照]
投与開始15日目の有効率は94.1%(48/51)であった。主な原因菌であるクラミジア・トラコマティス及び淋菌に対する臨床効果(有効率)及び細菌学的効果(菌消失率)は、それぞれ、100%(12/12、6/6及び11/11、6/6)であった29)。
本試験で報告された主な副作用は下痢11.8%(9/76)、注射部位疼痛及び悪心各5.3%(4/76)であった29)。[7.2、7.4参照]
18. 薬効薬理
18.1 作用機序
細菌の70Sリボソームの50Sサブユニットと結合し、蛋白合成を阻害する30)。
18.2 抗菌作用
18.2.1 In vitroにおいて、ブドウ球菌属、レンサ球菌属等のグラム陽性菌、モラクセラ(ブランハメラ)・カタラーリス、インフルエンザ菌、淋菌、プレボテラ属等の一部グラム陰性菌、レジオネラ・ニューモフィラ、ペプトストレプトコッカス属、マイコプラズマ属、クラミジア属に抗菌作用を示し、その作用は他のマクロライド系抗生物質と同程度であった31)32)33)34)35)36)37)38)39)40)41)42)。
18.2.2 In vitro及びin vivo(マウス、ハムスター)において、黄色ブドウ球菌、肺炎球菌、インフルエンザ菌等の各種細菌を用いた感染症モデルで、アジスロマイシンの良好な組織移行性を反映し、従来のマクロライド系抗生物質よりも強い防御効果及び治療効果を示した34)35)43)44)45)。
18.2.3 黄色ブドウ球菌及びインフルエンザ菌に対して、1MIC以上の薬剤濃度で殺菌的な作用を示した31)。
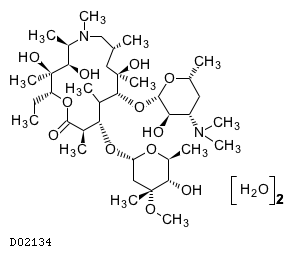
19. 有効成分に関する理化学的知見
19.1. アジスロマイシン水和物
22. 包装
10バイアル
23. 主要文献
- Kelsey,J.et al., Am J Obstet Gynecol., 170 (5-1), 1375-1376, (1994)
- Salman,S.et al., Antimicrob Agents Chemother., 60 (3), 1592-1599, (2015) »PubMed
- Sutton,AL.et al., Am J Obstet Gynecol., 212 (6), 812,e1-e6, (2015)
- Woldtvedt,B.R.et al., Ann Pharmacother., 32 (2), 269-270, (1998) »PubMed
- Lane,G., Ann Pharmacother., 30 (7/8), 884-885, (1996) »PubMed
- 社内資料:シクロスポリンとの薬物相互作用(2000年3月10日承認、申請資料概要ヘ.3.1.4)
- Amsden,G.W.et al., J Clin Pharmacol., 40 (12-2), 1522-1527, (2000)
- Gomes,T.et al., Clin Pharmacol Ther., 86 (4), 383-386, (2009) »PubMed
- 厚生労働省:重篤副作用疾患別対応マニュアル 薬剤性過敏症症候群
- 社内資料:ラット受胎能及び一般生殖能試験(2000年3月10日承認、申請資料概要二.3.1)
- 社内資料:ラット経口1ヵ月毒性試験(2000年3月10日承認、申請資料概要二.2.1)
- 社内資料:イヌ経口1ヵ月毒性試験(2000年3月10日承認、申請資料概要二.2.2)
- 社内資料:ラット経口6ヵ月毒性試験(2000年3月10日承認、申請資料概要二.2.3)
- 社内資料:イヌ経口6ヵ月毒性試験(2000年3月10日承認、申請資料概要二.2.4.1)
- 社内資料:イヌ経口6ヵ月毒性試験及び回復性試験(2000年3月10日承認、申請資料概要二.2.4.2)
- 社内資料:イヌ経口6ヵ月毒性試験(間欠投与)及び回復性試験(2000年3月10日承認、申請資料概要二.2.4.3)
- 社内資料:健康成人における単回投与及び反復投与時の安全性と薬物動態(2011年7月1日承認、CTD2.7.2.2.1)
- Foulds,G.et al., J Antimicrob Chemother., 25 (Suppl.A), 73-82, (1990)
- Luke,D.R.et al., Antimicrob Agents Chemother., 40 (11), 2577-2581, (1996) »PubMed
- Gladue,R.P.et al., Antimicrob Agents Chemother., 33 (3), 277-282, (1989) »PubMed
- 横山 秀一ほか, 日本化学療法学会雑誌, 43 (Suppl.6), 122-126, (1995)
- 社内資料:ヒトにおける尿及び胆汁中代謝物の検討(2000年3月10日承認、申請資料概要ヘ.3.1.3)
- 丁 宗鉄ほか, 日本化学療法学会雑誌, 43 (Suppl.6), 139-163, (1995)
- Mazzei,T.et al., J Antimicrob Chemother., 31 (Suppl.E), 57-63, (1993)
- 柴 孝也ほか, 日本化学療法学会雑誌, 43 (Suppl.6), 186-192, (1995)
- Hoffler,D.et al., Infection., 23 (6), 356-361, (1995) »PubMed
- 社内資料:市中肺炎に対する注射剤から経口剤への切り替え療法の非対照試験(2011年7月1日承認、CTD2.7.6(A0661191試験))
- 社内資料:市中肺炎に対する注射剤から経口剤への切り替え療法の比較試験(2011年7月1日承認、CTD2.7.6(93-CE33-0618試験))
- 社内資料:骨盤内炎症性疾患に対する注射剤から経口剤への切り替え療法の非対照試験(2012年6月22日承認、CTD2.7.6(A0661192試験))
- Retsema,J.et al., Antimicrob Agents Chemother., 31 (12), 1939-1947, (1987) »PubMed
- 松永 敏幸ほか, 日本化学療法学会雑誌, 43 (Suppl.6), 95-99, (1995)
- くわ原 京子ほか, 日本化学療法学会雑誌, 43 (Suppl.6), 24-30, (1995)
- 加藤 直樹ほか, 日本化学療法学会雑誌, 43 (Suppl.6), 31-39, (1995)
- Ishida,K.et al., Antimicrob Agents Chemother., 38 (4), 790-798, (1994) »PubMed
- Niki,Y.et al., Antimicrob Agents Chemother., 38 (10), 2296-2299, (1994) »PubMed
- Choi,GE.et al., Korean J Lab Med., 30 (1), 28-33, (2010) »PubMed
- 小川 美保ほか, Pharma Medica., 24 (3), 109-119, (2006)
- Mikamo,H.et al., Chemotherapy., 49 (1-2), 62-65, (2003) »PubMed
- Kuriyama,T.et al., Oral Microbiol Immunol., 22 (4), 285-288, (2007) »PubMed
- 金子 明寛, 日本口腔外科学会雑誌, 56 (10), 546-552, (2010) »DOI
- Waites,KB.et al., Antimicrob Agents Chemother., 53 (5), 2139-2141, (2009) »PubMed
- Hamasuna,R.et al., Antimicrob Agents Chemother., 53 (11), 4938-4939, (2009) »PubMed
- 松永 敏幸ほか, 日本化学療法学会雑誌, 43 (Suppl.6), 68-83, (1995)
- 西野 武志ほか, 日本化学療法学会雑誌, 43 (Suppl.6), 40-54, (1995)
- 長島 正人ほか, 日本化学療法学会雑誌, 43 (Suppl.6), 8-23, (1995)
24. 文献請求先及び問い合わせ先
文献請求先
ファイザー株式会社
Pfizer Connect/メディカル・インフォメーション
〒151-8589
東京都渋谷区代々木3-22-7
電話:0120-664-467
製品情報問い合わせ先
ファイザー株式会社
Pfizer Connect/メディカル・インフォメーション
〒151-8589
東京都渋谷区代々木3-22-7
電話:0120-664-467
26. 製造販売業者等
26.1 製造販売元
ファイザー株式会社
東京都渋谷区代々木3-22-7