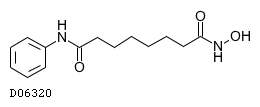
医薬品情報
| 総称名 | ゾリンザ |
|---|---|
| 一般名 | ボリノスタット |
| 欧文一般名 | Vorinostat |
| 製剤名 | ボリノスタットカプセル |
| 薬効分類名 | 抗悪性腫瘍剤 ヒストン脱アセチル化酵素阻害剤 |
| 薬効分類番号 | 4291 |
| ATCコード | L01XH01 |
| KEGG DRUG |
D06320
ボリノスタット
|
| JAPIC | 添付文書(PDF) |
添付文書情報2025年10月 改訂(第2版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ゾリンザカプセル100mg | ZOLINZA Capsules 100mg | MSD | 4291025M1029 | 5723円/カプセル | 劇薬, 処方箋医薬品 |
1. 警告
本剤の投与にあたっては、緊急時に十分対応できる医療施設において、がん化学療法に十分な知識・経験を持つ医師のもとで、本剤の投与が適切と判断される症例についてのみ実施すること。また、治療開始に先立ち、患者又はその家族に有効性及び危険性を十分説明し、同意を得てから投与すること。
2. 禁忌
4. 効能または効果
5. 効能または効果に関連する注意
5.1 「17.臨床成績」の項の内容を熟知し、本剤の有効性及び安全性を十分に理解した上で、適応患者の選択を行うこと。
5.2 本剤以外の治療の実施についても慎重に検討した上で、適応患者の選択を行うこと。
5.3 本剤の皮膚以外の病変(内臓等)に対する有効性は確立していない。[17.1参照]
6. 用法及び用量
通常、成人にはボリノスタットとして1日1回400mgを食後経口投与する。なお、患者の状態により適宜減量する。
7. 用法及び用量に関連する注意
7.1 全身投与による他の抗悪性腫瘍剤との併用について、有効性及び安全性は確立していない。
7.2 本剤の投与については、以下の基準を目安に、休薬、減量又は投与中止の判断を行うこと。
| <休薬> NCI CTCAE ver. 3.0 Grade3又は4の毒性が認められた場合、Grade1以下に回復するまで、最大2週間休薬する。休薬に至った毒性がGrade1以下に回復した後減量して再開する。ただし、Grade3の貧血及び血小板減少症は、休薬は必須ではない。 |
| <用量変更> 投与量の減量は、下記に示した方法に従って実施する。 1回目の用量変更:1日1回300mg 2回目の用量変更:1日1回300mg5日間投与後2日間休薬 |
| <投与中止> 休薬に至った毒性が2週間以上Grade1以下まで回復しない場合、又は2回目の用量変更を実施したにもかかわらず、再度、休薬を必要とする毒性が認められた場合、投与を中止する。 |
8. 重要な基本的注意
8.1 脱水症状があらわれることがあるので、必要に応じて、補液、電解質補充等を行うこと。また、投与にあたっては、患者に、脱水の兆候や脱水を避けるための注意点を指導すること。過度の嘔吐、下痢等が認められた場合には、医師の診察を受けるよう患者を指導すること。[11.1.4参照]
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.3 肝機能障害患者
9.4 生殖能を有する者
9.4.1 妊娠する可能性のある女性には、本剤投与中及び最終投与後6ヵ月間において避妊する必要性及び適切な避妊法について説明すること。[9.5、15.2参照]
9.4.2 男性には、本剤投与中及び最終投与後3ヵ月間においてバリア法(コンドーム)を用いて避妊する必要性について説明すること。[15.2参照]
9.5 妊婦
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。本剤がヒト乳汁中へ移行するかは不明である。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
患者の状態を観察しながら慎重に投与すること。一般に生理機能が低下していることが多い。
10. 相互作用
10.2 併用注意
| クマリン系抗凝血剤: ワルファリン | プロトロンビン時間(PT)延長及びINR上昇があらわれることがある。PT及びINRを注意深くモニターすること。 | 機序不明 |
| バルプロ酸 | 消化管出血、血小板減少、貧血等の副作用が増強することがある。 | 機序不明 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 肺塞栓症(4.7%)、深部静脈血栓症(1.2%)[9.1.1参照]
11.1.2 血小板減少症(25.6%)[8.3参照]
11.1.3 貧血(12.8%)[8.3参照]
11.1.4 脱水症状(1.2%)[8.1参照]
11.1.6 腎不全(頻度不明*)[8.3参照]
皮膚T細胞性リンパ腫(CTCL)患者を対象にした海外臨床試験(001試験及び005試験)において1日1回400mg投与で認められた副作用の頻度を基に記載した。
*:CTCL患者を対象にした国内臨床試験(089試験、1日1回400mg投与)、CTCL以外の患者を対象にした海外臨床試験及びCTCL患者を対象にした海外臨床試験(001試験及び005試験)において1日1回400mg投与以外で認められた副作用
11.2 その他の副作用
| 10%以上 | 10%未満 | 頻度不明* | |
| 感染症 | レンサ球菌性菌血症 | 憩室炎 | |
| 血液 | 好中球減少症、白血球減少症、リンパ球数減少 | 溶血 | |
| 精神・神経系 | 浮動性めまい、頭痛、錯感覚、嗜眠、失神 | 虚血性脳卒中 | |
| 循環器 | 高血圧、動悸 | 低血圧、血管炎 | |
| 呼吸器 | 呼吸困難、咳嗽 | 喀血 | |
| 消化器 | 下痢、悪心、口内乾燥、嘔吐、便秘 | 腹痛、上腹部痛、胃食道逆流性疾患、胃腸出血 | 嚥下障害 |
| 肝胆道系 | ALT増加、AST増加 | 肝虚血、高ビリルビン血症 | |
| 皮膚 | 脱毛症 | 皮膚剥脱、多汗症 | |
| 泌尿器 | 血中クレアチニン増加 | 蛋白尿、血尿 | 尿閉 |
| 電解質 | 高マグネシウム血症、低カリウム血症 | 低ナトリウム血症 | |
| その他 | 筋痙縮、味覚異常、疲労、悪寒、食欲不振、体重減少 | 味覚減退、発熱、胸痛、末梢性浮腫、冷感、血管神経性浮腫 | 腫瘍出血、霧視、難聴、無力症、高トリグリセリド血症、倦怠感 |
14. 適用上の注意
14.1 薬剤交付時の注意
PTP包装の薬剤はPTPシートから取り出して服用するよう指導すること。PTPシートの誤飲により、硬い鋭角部が食道粘膜へ刺入し、更には穿孔を起こして縦隔洞炎等の重篤な合併症を併発することがある。
14.2 薬剤投与時の注意
カプセルを開けたり、つぶしたりしないこと。カプセル内の粉末を皮膚又は粘膜に直接接触させないこと。直接接触した場合には、完全に洗い流すこと。
15. その他の注意
15.2 非臨床試験に基づく情報
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
固形がん患者におけるボリノスタット100〜500mg食後単回経口投与注1)後の血清中濃度時間曲線下面積(AUC)及び最高血清中濃度(Cmax)はおおむね用量に比例して増加した(図及び表1)3)。
図 固形がん患者におけるボリノスタット食後単回経口投与後の平均血清中濃度推移
| 用量(mg) | 例数 | AUC0-∞(μM・hr) | Cmax(μM) | Tmax(hr) | t1/2(hr) |
| 100 | 3 | 0.98* | 0.21±0.14 | 4.00(2.98,10.00) | 1.62* |
| 200 | 6 | 2.22±0.89 | 0.59±0.22 | 3.00(2.00,4.00) | 1.36±0.28 |
| 400 | 3 | 4.30±0.37 | 0.93±0.12 | 3.00(1.50,6.08) | 2.01±1.47 |
| 500 | 6 | 5.93±1.78 | 1.35±0.39 | 3.49(1.00,4.03) | 1.60±0.66 |
16.1.2 反復投与
CTCL患者におけるボリノスタット400mg28日間1日1回食後反復経口投与後のAUC0-∞、Cmax、Tmax及びt1/2(平均±標準偏差、Tmaxは中央値[範囲])はそれぞれ5.56±1.46μM・hr、1.17±0.37μM、3.7[2.9-4.3]hr及び2.30±1.10hrであり、初回投与時と比べ、これらパラメータに顕著な変化はみられなかった。AUCに基づく累積係数は1.18であった4)。
16.1.3 食事の影響
固形がん患者におけるボリノスタット400mg食後(高脂肪食)単回経口投与後のAUC0-∞及びCmaxは空腹時単回経口投与後のそれぞれ1.38倍及び0.91倍であった。摂食によりTmaxは1.5時間から4時間に遅延したが、t1/2は変化しなかった5)(外国人データ)。
16.3 分布
1.9〜190μMの濃度範囲において、ボリノスタットのヒト血漿蛋白結合率は68〜76%であった6)(In vitro)。
16.4 代謝
16.4.1 固形がん患者におけるボリノスタット400mg反復経口投与後(定常状態)の主要代謝物はO-グルクロン酸抱合体及びヒドロキサム酸基の加水分解後のβ-酸化で生成する4-アニリノ-4-オキソブタン酸であり注2)、血清中曝露量はボリノスタットと比べ、それぞれ約2及び8倍高かった3)7)。
16.4.2 ヒト肝ミクロソームを用いた検討において、チトクロームP450(CYP)の関与を示唆するボリノスタットの代謝物は認められなかった。また、ボリノスタットはヒトcDNA発現系のUDP-グルクロン酸転移酵素(UGT)1A1、1A3、1A7、1A8、1A9、2B7及び2B17によりグルクロン酸抱合を受けた。ヒト肝細胞では、ボリノスタットは臨床血清中濃度より高い10μMにおいてCYP2C9とCYP3A4の代謝活性を抑制した8)(In vitro)。
16.5 排泄
固形がん患者におけるボリノスタット400mg反復経口投与後(定常状態)24時間の未変化体及び代謝物であるO-グルクロン酸抱合体及び4-アニリノ-4-オキソブタン酸注2)の尿中排泄率はそれぞれ投与量の1%未満、23%及び57%であった4)。
16.6 特定の背景を有する患者
16.6.1 肝機能障害患者
肝機能注3)の異なる固形がん患者に本剤400mgを経口単回投与後の血清中薬物動態パラメータは、表2のとおりであった。なお、これらの患者間で統計的に有意な差はなかった9)(外国人データ)。[2.2、7.3、9.3.1、9.3.2、17.3.1参照]
| 肝機能 | n | AUC0-∞(μM・hr) | Cmax(μM) | Tmax(hr) | t1/2(hr) | CLapp(L/min) |
| 正常 | 15 | 5.1±1.9 | 1.4±0.5 | 1.4±0.8 | 2.5±1.2 | 6.4±5.1 |
| 軽度 | 15 | 7.7±3.4 | 2.2±1.1 | 2.3±2.0 | 2.0±1.4 | 4.0±1.8 |
| 中等度 | 15 | 7.5±2.4 | 1.7±0.6 | 2.7±1.9 | 3.5±2.8 | 3.8±1.6 |
| 重度 | 9 | 8.3±5.1 | 1.8±0.7 | 2.6±2.2 | 2.9±1.5 | 4.2±2.3 |
注1)本剤の承認用法・用量は、通常、成人にはボリノスタットとして1日1回400mgを食後経口投与である。
注2)両代謝物は薬理活性を有さない。
注3)肝機能はNCI-ODWG基準により分類
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 海外後期第II相試験(001試験)
CTCL患者を対象とした非盲検、非対照試験10)において、本剤1日1回400mgが投与されたCTCL患者の有効性は表1のとおりであった。
| 74例 | |
| 治験実施計画書前治療規定数注1) | 2種類以上 |
| 対象病期(Stage) | StageIIB以上注2) |
| 奏効率注3) | |
| 全体 | 29.5%(18/61) |
| 菌状息肉症 | 25.8%(8/31) |
| セザリー症候群 | 33.3%(10/30) |
17.1.2 国内第I相試験(089試験)
CTCL患者を対象とした非盲検、非対照試験11)において、本剤1日1回400mgが投与されたCTCL患者の有効性は表2のとおりであった。
| 10例 | |
| 治験実施計画書前治療規定数注4) | 1種類以上注5) |
| 対象病期(Stage) | StageIIB以上 |
| 奏効率注6) | |
| 全体 | 10%(1/10)注7) |
| 菌状息肉症 | 10%(1/10)注7) |
| セザリー症候群 | NA(0/0) |
CTCL患者10例中10例に副作用(臨床検査値の異常変動を含む)が認められた。主な副作用は、血小板減少症が8例、悪心が6例、倦怠感が5例、嘔吐、高クレアチニン血症、食欲不振及び味覚異常が各4例、高ビリルビン血症、高血糖、高マグネシウム血症、高トリグリセリド血症、白血球減少症、リンパ球減少症及び体重減少が各3例、下痢、頭痛、高血圧、発熱、貧血、疲労及び腎機能障害が各2例であった。
17.1.3 海外前期第II相試験(005試験)
CTCL又は末梢T細胞性リンパ腫患者を対象とした非盲検、非対照試験において、本剤1日1回400mgが投与された患者の奏効率(評価方法:Physician's Global Assessment;PGA)は30.8%(4/13例)であった。なお、005試験の対象病期はStageIA以上であったが、実際に組み入れられた患者はStageIB以上であった。また各患者の全身投与による前治療は1種類以上であった12)。
17.3 その他
17.3.1 肝機能障害患者[海外第I相試験(075試験)]
肝機能注8)の異なる固形がん患者57例(肝機能正常者16例、軽度肝障害患者15例、中等度肝障害患者15例、重度肝障害患者11例)に本剤を1日1回反復経口投与したときの安全性について評価した。400mgコホートの軽度肝障害患者2/7例で用量制限毒性(Grade3の脱水及び下痢1例、Grade3の脱水及びGrade4の血小板減少症1例)が認められ、軽度の肝障害患者での最大耐用量は300mgであった。300mgコホートの中等度肝障害患者2/4例で用量制限毒性(Grade4の血小板減少症2例)が認められ、中等度の肝障害患者での最大耐用量は200mgであった。200mgコホートの重度肝障害患者2/3例で用量制限毒性(Grade4の血小板減少症2例)が認められ、重度の肝障害患者での最大耐用量は100mgであった9)。[2.2、7.3、9.3.1、9.3.2、16.6.1参照]
注8)肝機能はNCI-ODWG基準により分類
18. 薬効薬理
18.1 作用機序
18.2 抗腫瘍効果
19. 有効成分に関する理化学的知見
19.1. ボリノスタット
22. 包装
28カプセル[14カプセル(PTP)×2]
23. 主要文献
- 社内資料:生殖発生毒性試験(2011年7月1日承認、CTD 2.6.6.6)
- 社内資料:遺伝毒性試験(2011年7月1日承認、CTD 2.6.6.4)
- Fujiwara Y,et al., Cancer Sci., 100, 1728-34, (2009) »PubMed
- 社内資料:国内第I相試験(089試験):薬物動態成績(2011年7月1日承認、CTD 2.7.2.2)
- Rubin EH,et al., Clin Cancer Res., 12, 7039-45, (2006) »PubMed
- 社内資料:In vitroにおける血漿蛋白結合(2011年7月1日承認、CTD 2.6.4.4)
- 社内資料:国内第I相試験(029試験):薬物動態成績(2011年7月1日承認、CTD 2.7.2.2)
- 社内資料:ヒト試料によるin vitro代謝(2011年7月1日承認、CTD 2.6.4.5)
- Ramalingam SS,et al., J Clin Oncol., 28, 4507-12, (2010) »PubMed
- Olsen EA,et al., J Clin Oncol., 25, 3109-15, (2007) »PubMed
- 社内資料:国内第I相試験(089試験):臨床成績(2011年7月1日承認、CTD 2.7.6.2)
- Duvic M,et al., Blood., 109, 31-9, (2007) »PubMed
- 社内資料:ヒストン脱アセチル化酵素阻害作用(2011年7月1日承認、CTD 2.6.2.2)
- 社内資料:ボリノスタットの作用機序(2011年7月1日承認、CTD 2.6.2.2)
- 社内資料:In vitro増殖阻害作用(2011年7月1日承認、CTD 2.6.2.2)
- 社内資料:In vivo有効性試験
24. 文献請求先及び問い合わせ先
文献請求先
大鵬薬品工業株式会社
医薬品情報課
〒101-8444
東京都千代田区神田錦町1-27
電話:0120-20-4527
製品情報問い合わせ先
大鵬薬品工業株式会社
医薬品情報課
〒101-8444
東京都千代田区神田錦町1-27
電話:0120-20-4527
26. 製造販売業者等
26.1 製造販売元
MSD株式会社
東京都千代田区九段北1-13-12
26.2 販売元
大鵬薬品工業株式会社
東京都千代田区神田錦町1-27