医薬品情報
| 総称名 | アセリオ |
|---|---|
| 一般名 | アセトアミノフェン |
| 欧文一般名 | Acetaminophen |
| 製剤名 | アセトアミノフェン静注液 |
| 薬効分類名 | 解熱鎮痛剤 |
| 薬効分類番号 | 1141 |
| ATCコード | N02BE01 |
| KEGG DRUG |
D00217
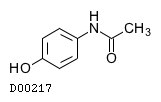
アセトアミノフェン
|
| JAPIC | 添付文書(PDF) |
添付文書情報2023年10月 改訂(第3版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| アセリオ静注液1000mgバッグ | acelio Bag for Intravenous Injection 1000mg | テルモ | 1141400A2020 | 298円/袋 | 劇薬, 処方箋医薬品注) |
1. 警告
2. 禁忌
次の患者には投与しないこと
2.1 重篤な肝障害のある患者[9.3.1、11.1.4参照]
2.2 本剤の成分に対し過敏症の既往歴のある患者[11.1.1参照]
4. 効能または効果
経口製剤及び坐剤の投与が困難な場合における疼痛及び発熱
5. 効能または効果に関連する注意
経口製剤及び坐剤の投与が困難で、静注剤による緊急の治療が必要である場合等、静注剤の投与が臨床的に妥当である場合に本剤の使用を考慮すること。経口製剤又は坐剤の投与が可能になれば速やかに投与を中止し、経口製剤又は坐剤の投与に切り替えること。
6. 用法及び用量
下記のとおり本剤を15分かけて静脈内投与すること。
<成人における疼痛>
通常、成人にはアセトアミノフェンとして、1回300〜1000mgを15分かけて静脈内投与し、投与間隔は4〜6時間以上とする。なお、年齢、症状により適宜増減するが、1日総量として4000mgを限度とする。
ただし、体重50kg未満の成人にはアセトアミノフェンとして、体重1kgあたり1回15mgを上限として静脈内投与し、投与間隔は4〜6時間以上とする。1日総量として60mg/kgを限度とする。
ただし、体重50kg未満の成人にはアセトアミノフェンとして、体重1kgあたり1回15mgを上限として静脈内投与し、投与間隔は4〜6時間以上とする。1日総量として60mg/kgを限度とする。
<成人における発熱>
通常、成人にはアセトアミノフェンとして、1回300〜500mgを15分かけて静脈内投与し、投与間隔は4〜6時間以上とする。なお、年齢、症状により適宜増減するが、原則として1日2回までとし、1日最大1500mgを限度とする。
<2歳以上の幼児及び小児における疼痛及び発熱>
通常、2歳以上の幼児及び小児にはアセトアミノフェンとして、体重1kgあたり1回10〜15mgを15分かけて静脈内投与し、投与間隔は4〜6時間以上とする。なお、年齢、症状により適宜増減するが、1日総量として60mg/kgを限度とする。ただし、成人の用量を超えない。
<乳児及び2歳未満の幼児における疼痛及び発熱>
通常、乳児及び2歳未満の幼児にはアセトアミノフェンとして、体重1kgあたり1回7.5mgを15分かけて静脈内投与し、投与間隔は4〜6時間以上とする。なお、年齢、症状により適宜増減するが、1日総量として30mg/kgを限度とする。
7. 用法及び用量に関連する注意
7.1 本剤の投与に際しては、投与速度を厳守すること(本剤の有効性及び安全性は本剤を15分かけて静脈内投与した臨床試験において確認されている)。
7.2 乳児、幼児及び小児の1回投与量の目安は下記のとおりである。[9.7.1参照]
| 体重 | 1回投与量の目安 |
| 5kg | 3.75mL |
| 10kg | 7.5〜15mL |
| 20kg | 20〜30mL |
| 30kg | 30〜45mL |
7.3 乳児、幼児及び小児に対する1回あたりの最大用量はアセトアミノフェンとして500mg、1日あたりの最大用量はアセトアミノフェンとして1500mgである。[9.7.1参照]
7.4 他の消炎鎮痛剤との併用は避けることが望ましい。
7.5 本剤とアセトアミノフェンを含む他の薬剤(一般用医薬品を含む)との併用により、アセトアミノフェンの過量投与による重篤な肝障害が発現するおそれがあることから、特に総合感冒剤や解熱鎮痛剤等の配合剤を併用する場合は、アセトアミノフェンが含まれていないか確認し、含まれている場合は併用を避けること。[1.2、8.5参照]
7.6 アスピリン喘息又はその既往歴のある患者に対する1回あたりの最大用量はアセトアミノフェンとして300mg以下とすること。[9.1.8参照]
8. 重要な基本的注意
8.1 本剤の投与速度及び投与量により、循環動態に影響を及ぼすことが明らかに予想される患者には投与しないこと。
8.2 本剤の使用は、発熱、痛みの程度を考慮し、最小限の投与量及び期間にとどめること。
8.3 解熱鎮痛剤による治療は原因療法ではなく、対症療法であることに留意すること。原因療法があればこれを行うこと。
8.4 本剤の投与直後には経口製剤及び坐剤に比べて血中濃度が高くなることから、過度の体温下降、虚脱、四肢冷却等の発現に特に留意すること。特に高熱を伴う高齢者及び小児等又は消耗性疾患の患者においては、投与後の患者の状態に十分注意すること。
8.6 アセトアミノフェンの高用量投与により副作用として腹痛・下痢がみられることがある。本剤においても同様の副作用があらわれるおそれがあり、疼痛又は発熱の原疾患に伴う消化器症状と区別できないおそれがあるので、観察を十分行い慎重に投与すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 アルコール多量常飲者
肝障害があらわれやすくなる。[10.2、11.1.4参照]
9.1.2 絶食・低栄養状態・摂食障害等によるグルタチオン欠乏、脱水症状のある患者
肝障害があらわれやすくなる。[11.1.4参照]
9.1.3 消化性潰瘍又はその既往歴のある患者
症状が悪化又は再発を促すおそれがある。
9.1.4 血液の異常又はその既往歴のある患者
症状が悪化又は再発を促すおそれがある。[11.1.5参照]
9.1.5 出血傾向のある患者
血小板機能異常が起こることがある。
9.1.6 心機能異常のある患者
症状が悪化又は心不全が増悪するおそれがある。
9.1.7 気管支喘息のある患者
症状が悪化するおそれがある。[11.1.3参照]
9.1.8 アスピリン喘息(非ステロイド性消炎鎮痛剤による喘息発作の誘発)又はその既往歴のある患者
9.1.9 感染症を合併している患者
必要に応じて適切な抗菌剤を併用し、観察を十分に行い慎重に投与すること。感染症を不顕性化するおそれがある。
9.2 腎機能障害患者
9.2.1 腎障害又はその既往歴のある患者
投与量の減量、投与間隔の延長を考慮すること。症状が悪化又は再発を促すおそれがある。[11.1.7参照]
9.3 肝機能障害患者
9.3.1 重篤な肝障害のある患者
投与しないこと。重篤な転帰をとるおそれがある。[2.1参照]
9.3.2 肝障害又はその既往歴のある患者(重篤な肝障害のある患者を除く)
肝機能が悪化するおそれがある。[11.1.4参照]
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、次のリスクを考慮し、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。
・妊娠後期の女性への投与により、胎児に動脈管収縮を起こすことがある。
・妊娠後期のラットに投与した実験で、弱い胎仔の動脈管収縮が報告されている1)。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。
9.7 小児等
9.7.2 低出生体重児、新生児及び3カ月未満の乳児を対象とした有効性及び安全性を指標とした臨床試験は実施していない。
9.8 高齢者
副作用の発現に特に注意し、少量から投与を開始し、必要最小限の使用にとどめるなど患者の状態を観察しながら慎重に投与すること。
10. 相互作用
10.2 併用注意
| アルコール (飲酒) [9.1.1参照] | アルコール多量常飲者がアセトアミノフェンを服用したところ肝不全を起こしたとの報告がある。 | アルコール常飲によるCYP2E1の誘導により、アセトアミノフェンから肝毒性を持つN-アセチル-p-ベンゾキノンイミンへの代謝が促進される。 |
| クマリン系抗凝固剤 ワルファリン | クマリン系抗凝固剤の作用を増強することがあるので、減量するなど慎重に投与すること。 | 作用機序については、ワルファリンの酸化経路又はビタミンK依存性凝固因子合成関連酵素への作用が考えられている。 |
| イソニアジド | イソニアジドの長期連用者において、肝薬物代謝酵素が誘導され、肝障害を生じやすくなるとの報告がある。 | イソニアジドはCYP2E1を誘導する。そのためアセトアミノフェンから肝毒性を持つN-アセチル-p-ベンゾキノンイミンへの代謝が促進される。 |
| カルバマゼピン フェノバルビタール フェニトイン プリミドン リファンピシン | これらの薬剤の長期連用者において、アセトアミノフェンの血中濃度が低下するとの報告がある。 | これらの薬剤の肝薬物代謝酵素誘導作用により、アセトアミノフェンの代謝が促進され血中濃度が低下する。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には投与を中止するなど適切な処置を行うこと。
11.1.1 ショック、アナフィラキシー(いずれも頻度不明)
ショック、アナフィラキシー(呼吸困難、全身紅潮、血管浮腫、蕁麻疹等)があらわれることがある。[2.2参照]
11.1.2 中毒性表皮壊死融解症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)、急性汎発性発疹性膿疱症(いずれも頻度不明)
11.1.4 劇症肝炎、肝機能障害、黄疸(いずれも頻度不明)
劇症肝炎、AST、ALT、γ-GTPの上昇等を伴う肝機能障害、黄疸があらわれることがある。[1.1、2.1、8.7、9.1.1、9.1.2、9.3.2参照]
11.1.5 顆粒球減少症(頻度不明)[9.1.4参照]
11.1.6 間質性肺炎(頻度不明)
咳嗽、呼吸困難、発熱、肺音の異常等が認められた場合には、速やかに胸部X線、胸部CT、血清マーカー等の検査を実施すること。異常が認められた場合には投与を中止し、副腎皮質ホルモン剤の投与等の適切な処置を行うこと。
11.1.7 間質性腎炎、急性腎障害(いずれも頻度不明)[9.2.1参照]
11.1.8 薬剤性過敏症症候群(頻度不明)
初期症状として発疹、発熱がみられ、更に肝機能障害、リンパ節腫脹、白血球増加、好酸球増多、異型リンパ球出現等を伴う遅発性の重篤な過敏症状があらわれることがある。なお、ヒトヘルペスウイルス6(HHV-6)等のウイルスの再活性化を伴うことが多く、投与中止後も発疹、発熱、肝機能障害等の症状が再燃あるいは遷延化することがあるので注意すること。
11.2 その他の副作用
| 頻度不明 | |
| 血液 | チアノーゼ、血小板減少、血小板機能低下(出血時間の延長)注) |
| 消化器 | 悪心・嘔吐、食欲不振 |
| 循環器 | 血圧低下 |
| その他 | 過敏症注)、発汗 |
13. 過量投与
14. 適用上の注意
14.1 薬剤投与前の注意
14.1.1 低温下では、結晶析出の可能性がある。結晶が析出した場合は、湯煎(60℃以下)にて加温溶解後、放冷して使用すること。
14.2 薬剤投与時の注意
14.2.1 針は、ゴム栓の刻印部(○印)に垂直にゆっくり刺すこと。斜めに刺した場合、削り片の混入及び液漏れの原因となるおそれがある。また、針は同一箇所に繰り返し刺さないこと。
14.2.2 本剤への他剤の混注は行わないこと。
14.2.3 容器の目盛りは目安として使用すること。
14.2.4 残液は使用しないこと。
15. その他の注意
15.1 臨床使用に基づく情報
15.1.1 類似化合物(フェナセチン)の長期投与により、血色素異常を起こすことがある。
15.1.2 腎盂及び膀胱腫瘍の患者を調査したところ、類似化合物(フェナセチン)製剤を長期・大量に使用(例:総服用量1.5〜27kg、服用期間4〜30年)していた人が多いとの報告がある。
15.1.3 非ステロイド性消炎鎮痛剤を長期間投与されている女性において、一時的な不妊が認められたとの報告がある。
15.2 非臨床試験に基づく情報
類似化合物(フェナセチン)を長期・大量投与した動物実験で、腫瘍発生が認められたとの報告がある。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
(1)日本人健康成人男性に本剤30、65、100mL(アセトアミノフェンとして300、650、1000mg)をいずれも15分かけて静脈内投与したとき、血漿中アセトアミノフェン濃度推移及び薬物動態パラメータは以下に示すとおりであった。用量にかかわらず、血漿中濃度は投与終了直後にCmaxに達した後、約2.5時間のt1/2で低下した。300mgから1000mgの用量範囲で、血漿中アセトアミノフェン濃度のCmax及びAUCは用量に比例して増加し、線形性が認められた2)。
血漿中アセトアミノフェン濃度推移(平均値+標準偏差)
| 用量 | 平均値(標準偏差)、例数=8 | ||||
| AUC0-t(μg・hr/mL) | Cmax(μg/mL) | t1/2(hr) | CL(L/hr/kg) | tmax(hr) | |
| 300mg | 17.38(1.87) | 11.06(1.37) | 2.79(0.28) | 0.238(0.033) | 0.25(0.0) |
| 650mg | 44.29(4.15) | 22.35(5.72) | 2.83(0.37) | 0.212(0.029) | 0.25(0.0) |
| 1000mg | 59.72(10.83) | 46.17(5.93) | 2.59(0.20) | 0.253(0.042) | 0.25(0.0) |
(2)日本人健康成人男性に本剤100mLと経口製剤(いずれもアセトアミノフェンとして1000mg)をクロスオーバー法により単回投与(本剤の投与速度100mL/15分)したとき、血漿中アセトアミノフェン濃度推移及び薬物動態パラメータは以下に示すとおりであった。Cmaxの増加、tmaxの短縮はあったが投与後30分以降の血漿中濃度は経口製剤と同様の推移を示し、AUCやt1/2、尿中代謝物プロファイル等その他薬物動態パラメータに投与経路による違いは認められなかった3)。
血漿中アセトアミノフェン濃度推移(平均値+標準偏差)
| 投与薬剤 | 例数 | 平均値(標準偏差) | ||||
| AUC0-t(μg・hr/mL) | Cmax(μg/mL) | t1/2(hr) | CL(L/hr/kg) | tmax(hr) | ||
| アセトアミノフェン静注液(1000mg、1バイアル) | 19 | 60.01(8.66) | 43.01(6.62) | 2.72(0.38) | 0.256(0.037) | 0.25(0.0) |
| アセトアミノフェン錠(200mg、5錠) | 20 | 53.62(9.87) | 23.56(8.51) | 2.78(0.47) | 0.285(0.051) | 0.49(0.24) |
(3)本剤を小児には1.5mL/kg(アセトアミノフェンとして15mg/kg)及び成人には100mL(アセトアミノフェンとして1000mg)を単回静脈内投与した際の薬物動態パラメータの推定値を以下に要約する(外国人データ)4)。幼児及び青年におけるAUCは成人と同程度であるが、新生児及び乳児では成人より大きい。生後1カ月以上2歳未満の乳児及び28日齢までの新生児においては、用量をそれぞれ33%及び50%減量し、投与間隔を6時間以上空けることにより、2歳以上の小児と同様のAUCが得られることが、乳児及び新生児の薬物動態データに基づいた用量シミュレーションにより示されている注)。
| サブ集団 | 平均値(標準偏差) | ||||
| AUC(μg・hr/mL) | Cmax(μg/mL) | t1/2(hr) | CL(L/hr/kg) | Vss(L/kg) | |
| 新生児 | 62(11) | 25(4) | 7.0(2.7) | 0.12(0.04) | 1.1(0.2) |
| 乳児 | 57(54) | 29(24) | 4.2(2.9) | 0.29(0.15) | 1.1(0.3) |
| 幼児 | 38(8) | 29(7) | 3.0(1.5) | 0.34(0.10) | 1.2(0.3) |
| 青年 | 41(7) | 31(9) | 2.9(0.7) | 0.29(0.08) | 1.1(0.3) |
| 成人 | 43(11) | 28(21) | 2.4(0.6) | 0.27(0.08) | 0.8(0.2) |
注)乳児及び2歳未満の幼児における用法・用量は以下のとおりである。
通常、乳児及び2歳未満の幼児にはアセトアミノフェンとして、体重1kgあたり1回7.5mgを15分かけて静脈内投与し、投与間隔は4〜6時間以上とする。なお、年齢、症状により適宜増減するが、1日総量として30mg/kgを限度とする。
16.1.2 反復投与
日本人健康成人男性に本剤65mL(アセトアミノフェンとして650mg)を1日6回(4時間毎)2日間反復静脈内投与(投与速度65mL/15分)又は本剤100mL(アセトアミノフェンとして1000mg)を1日4回(6時間毎)2日間反復静脈内投与(投与速度100mL/15分)したときの薬物動態パラメータは以下に示すとおりであった。いずれも反復投与開始後12時間までに定常状態に達し、蓄積性は認められなかった2)。
| 用量 | 投与(回) | 平均値(標準偏差)、例数=8 | ||||
| AUCτ(μg・hr/mL) | Cmax(μg/mL) | t1/2(hr) | CL(L/hr/kg) | tmax(hr) | ||
| 650mg | 1 | 30.66(4.62) | 31.22(1.95) | 2.53(0.32) | 0.244(0.033) | 0.25(0.0) |
| 12 | 44.34(6.42) | 32.47(3.47) | 2.61(0.21) | 0.241(0.021) | 0.25(0.0) | |
| 1000mg | 1 | 52.35(5.77) | 42.05(7.13) | 2.39(0.14) | 0.274(0.035) | 0.25(0.0) |
| 8 | 64.37(11.31) | 49.23(5.28) | 2.65(0.32) | 0.268(0.038) | 0.25(0.0) | |
16.3 分布
16.3.1 アセトアミノフェンの血漿蛋白結合率は低く、血漿中濃度60μg/mLまでは結合はみられず、血漿中濃度280μg/mLにおいても約20%であった(外国人データ)5)。
16.3.2 妊娠した女性を対象とした試験で、アセトアミノフェンの経胎盤移行が示されている(外国人データ)6)。
16.4 代謝
アセトアミノフェンの代謝は主に肝臓で行われ、主な代謝経路には、グルクロン酸抱合、硫酸抱合、チトクロムP450を介した酸化的代謝経路の3つがある。チトクロムP450を介した酸化的代謝経路では、主としてCYP2E1により反応性中間代謝物[N-アセチル-p-ベンゾキノンイミン(NAPQI)]が生成される。治療用量では、NAPQIは迅速にグルタチオン抱合を受け、その後さらに代謝されてシステイン及びメルカプツール酸との抱合体を形成する7)。
16.5 排泄
アセトアミノフェン代謝物は主に尿中に排泄される。日本人成人男性に本剤100mL(アセトアミノフェンとして1000mg)を投与したとき、投与量の約80%が12時間以内に、90%以上が48時間以内に尿中に排泄された。また、アセトアミノフェン未変化体及び各代謝物の尿中累積排泄率は、経口製剤と同程度であった3)。
17. 臨床成績
17.1 有効性及び安全性に関する試験
<成人における疼痛>
17.1.1 海外第III相臨床試験
第三大臼歯抜歯後に中等度以上の疼痛を認めた患者152例を対象として、本剤100mL(アセトアミノフェンとして1000mg)、プロパセタモール注1)2000mg又はプラセボを単回投与(投与速度100mL/15分)した。投与後0.25〜6時間までの各評価時点における本剤投与群の痛みの改善度は、いずれの時点においても、プラセボ投与群に比して有意な差が認められた(0.25〜6時間の全時点でp<0.001)。
本剤投与群の有害事象発現率は27.5%(14/51例)で、主な有害事象はめまい4例(7.8%)、遅延性の術後痛3例(5.9%)であった8)。
本剤投与群の有害事象発現率は27.5%(14/51例)で、主な有害事象はめまい4例(7.8%)、遅延性の術後痛3例(5.9%)であった8)。
<小児における疼痛>注2)
17.1.2 海外第III相臨床試験
鼡径ヘルニア修復術を受け、術後に中等度以上の痛みを認めた小児患者185例(1〜12歳)を対象として、本剤1.5mL/kg(アセトアミノフェンとして15mg/kg)又はプロパセタモール注1)30mg/kgを15分かけて単回投与した。投与後0.25〜6時間までの各評価時点において疼痛強度をVisual Analog Scale(VAS)で評価し、ベースラインからの疼痛強度の差により鎮痛効果を評価したところ、いずれの時点においても、本剤投与群とプロパセタモール投与群で同程度の疼痛強度差が認められた。
本剤投与群の有害事象発現率は21.1%(20/95例)で、主な有害事象は注入部位疼痛14例(14.7%)、嘔吐5例(5.3%)であった9)。
本剤投与群の有害事象発現率は21.1%(20/95例)で、主な有害事象は注入部位疼痛14例(14.7%)、嘔吐5例(5.3%)であった9)。
<小児における発熱>注2)
17.1.3 海外第III相臨床試験
感染症による急性発熱(直腸体温38.5〜41℃)のある小児患者(1カ月〜12歳)67例を対象として、本剤1.5mL/kg(アセトアミノフェンとして15mg/kg)又はプロパセタモール注1)30mg/kgを15分かけて単回投与した。投与後6時間の体温変化を評価したところ、ベースライン時の体温39.4℃に対し、本剤投与群の平均最大体温低下は1.9℃であり、体温は投与後2時間で38℃以下になり、そのままの状態を3.5時間維持した。
本剤投与群の有害事象発現率は14.3%(5/35例)で、主な有害事象は局所の痛みもしくは反応2例(5.7%)、嘔吐1例(2.9%)であった10)。
本剤投与群の有害事象発現率は14.3%(5/35例)で、主な有害事象は局所の痛みもしくは反応2例(5.7%)、嘔吐1例(2.9%)であった10)。
注1)対照薬として用いられているプロパセタモールはアセトアミノフェンのプロドラッグであり、血漿エステラーゼによって速やかにアセトアミノフェンとジエチルグリシンに変換される(プロパセタモール2000mgは約1000mgのアセトアミノフェンに変換される)。国内未承認の医薬品である。
注2)乳児及び2歳未満の幼児における用法・用量は以下のとおりである。
通常、乳児及び2歳未満の幼児にはアセトアミノフェンとして、体重1kgあたり1回7.5mgを15分かけて静脈内投与し、投与間隔は4〜6時間以上とする。なお、年齢、症状により適宜増減するが、1日総量として30mg/kgを限度とする。
18. 薬効薬理
18.1 作用機序
アセトアミノフェンの作用の正確な部位や機序は完全には解明されていないが、解熱剤としての有効性は視床下部の体温調節中枢への作用に起因するとされ、鎮痛作用は視床と大脳皮質に作用して痛覚閾値を上昇させることによると考えられている。作用機序としては、中枢神経系に作用し、プロスタグランジン(PG)合成、カンナビノイド受容体系又はセロトニン作動系などに影響を及ぼすと考えられている11)。
18.2 鎮痛作用
アセトアミノフェンの静脈内単回投与は、雄マウスを用いたフェニルベンゾキノン腹腔内投与による侵害受容反応に対して鎮痛作用を示した12)。
19. 有効成分に関する理化学的知見
19.1. アセトアミノフェン
20. 取扱い上の注意
20.1 凍結保存しないこと。
20.2 品質保持のため、外袋は使用時まで開封しないこと。
20.3 次の場合には使用しないこと。
・外袋が破損している場合
・外袋内や容器表面に水滴や結晶が認められる場合
・容器から薬液が漏れている場合
・性状その他薬液に異状が認められる場合
・ゴム栓部のシールがはがれている場合
22. 包装
100mL×20袋[脱酸素剤入り]
23. 主要文献
- 門間和夫ほか, 小児科の進歩, 2, 95-101, (1983), (診断と治療社)
- 熊谷雄治, 臨床医薬, 29 (10), 875-887, (2013)
- 熊谷雄治, 臨床医薬, 29 (10), 889-897, (2013)
- OFIRMEV添付文書
- Gazzard BG et al., J Pharm Pharmacol., 25, 964-967, (1973) »PubMed »DOI
- Naga Rani MA et al., J Indian Med Assoc., 87 (8), 182-183, (1989)
- 福本真理子, 中毒研究, 16, 285-297, (2003)
- Moller PL et al., Anesthesia&Analgesia., 101 (1), 90-96, (2005)
- Murat I et al., Paediatr Anaesth., 15 (8), 663-670, (2005)
- Duhamel JF et al., Int J Clin Pharmacol Ther., 45 (4), 221-229, (2007)
- 鈴木孝浩, ペインクリニック, 33 (2), 218-226, (2012)
- テルモ株式会社:マウス薬理試験(社内資料)
24. 文献請求先及び問い合わせ先
文献請求先
テルモ
コールセンター
〒259-0151
神奈川県足柄上郡中井町井ノ口1500
電話:0120-12-8195
製品情報問い合わせ先
テルモ
コールセンター
〒259-0151
神奈川県足柄上郡中井町井ノ口1500
電話:0120-12-8195
26. 製造販売業者等
26.1 製造販売元
テルモ株式会社
東京都渋谷区幡ヶ谷2丁目44番1号