医薬品情報
| 総称名 | ハルロピ |
|---|---|
| 一般名 | ロピニロール塩酸塩 |
| 欧文一般名 | Ropinirole Hydrochloride |
| 製剤名 | ロピニロール塩酸塩経皮吸収型製剤 |
| 薬効分類名 | 経皮吸収型ドパミン作動性パーキンソン病治療剤 |
| 薬効分類番号 | 1169 |
| ATCコード | N04BC04 |
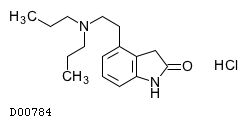
| KEGG DRUG |
D00784
ロピニロール塩酸塩
|
| KEGG DGROUP |
DG01967
抗パーキンソン病薬
|
| JAPIC | 添付文書(PDF) |
添付文書情報2022年4月 改訂(第1版)
商品情報 3.組成・性状
| 販売名 | 欧文商標名 | 製造会社 | YJコード | 薬価 | 規制区分 |
|---|---|---|---|---|---|
| ハルロピテープ8mg | HARUROPI Tapes | 久光製薬 | 1169701S1020 | 287.6円/枚 | 劇薬, 処方箋医薬品注) |
| ハルロピテープ16mg | HARUROPI Tapes | 久光製薬 | 1169701S2026 | 444円/枚 | 劇薬, 処方箋医薬品注) |
| ハルロピテープ24mg | HARUROPI Tapes | 久光製薬 | 1169701S3022 | 559.2円/枚 | 劇薬, 処方箋医薬品注) |
| ハルロピテープ32mg | HARUROPI Tapes | 久光製薬 | 1169701S4029 | 694.3円/枚 | 劇薬, 処方箋医薬品注) |
| ハルロピテープ40mg | HARUROPI Tapes | 久光製薬 | 1169701S5025 | 766.2円/枚 | 劇薬, 処方箋医薬品注) |
1. 警告
2. 禁忌
次の患者には投与しないこと
2.1 本剤の成分に対し過敏症の既往歴のある患者
2.2 妊婦又は妊娠している可能性のある女性[9.5参照]
4. 効能または効果
6. 用法及び用量
通常、成人にはロピニロール塩酸塩として1日1回8mgから始め、以後経過を観察しながら、必要に応じて1週間以上の間隔で、1日量として8mgずつ増量する。いずれの投与量の場合も1日1回、胸部、腹部、側腹部、大腿部又は上腕部のいずれかの皮膚に貼付し、24時間毎に貼り替える。なお、年齢、症状により適宜増減するが、ロピニロール塩酸塩として1日量64mgを超えないこととする。
7. 用法及び用量に関連する注意
使用は「6.用法及び用量」に従い少量から始め、消化器症状(悪心、嘔吐等)、血圧等の観察を十分に行いながら慎重に増量し、患者毎に適切な維持量を定めること。
8. 重要な基本的注意
8.1 ドパミン受容体作動薬の投与において、突発的睡眠により自動車事故を起こした例が報告されている。患者には突発的睡眠及び傾眠等についてよく説明し、自動車の運転、機械の操作、高所作業等危険を伴う作業に従事させないよう注意すること。なお、海外において突発的睡眠を起こした症例の中には、傾眠や過度の眠気のような前兆を認めなかった例あるいは投与開始後1年以上経過した後に初めて発現した例も報告されている。[1.、11.1.1参照]
8.2 起立性低血圧がみられることがあるので、使用は少量から始め、めまい、立ちくらみ、ふらつき等の起立性低血圧の徴候や症状が認められた場合には、減量、休薬又は使用中止等の適切な処置を行うこと。
8.3 減量、中止が必要な場合は、漸減すること。急激な減量又は中止により、高熱、意識障害、高度の筋硬直、不随意運動、ショック症状等の悪性症候群があらわれることがある。また、ドパミン受容体作動薬の急激な減量又は中止により、薬剤離脱症候群(無感情、不安、うつ、疲労感、発汗、疼痛等の症状を特徴とする)があらわれることがある。[11.1.3参照]
8.4 レボドパ又はドパミン受容体作動薬の投与により、病的賭博(個人的生活の崩壊等の社会的に不利な結果を招くにもかかわらず、持続的にギャンブルを繰り返す状態)、病的性欲亢進、強迫性購買、暴食等の衝動制御障害が報告されているので、このような症状が発現した場合には、減量又は使用を中止するなど適切な処置を行うこと。また、患者及び家族等にこのような衝動制御障害の症状について説明すること。
8.5 貼付により皮膚症状を起こすことがあるので、貼付箇所を毎回変更すること。皮膚症状があらわれた場合には、ステロイド軟膏等を投与する、本剤を使用中止するなど適切な処置を行うこと。
8.6 貼付してある製剤を除去せずに新たな製剤を貼付した場合、血中濃度が上昇するため、貼り替えの際は先に貼付した製剤を除去したことを十分に確認するよう患者及び介護者等に指導すること。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 幻覚、妄想等の精神症状又はそれらの既往のある患者
症状が増悪又は発現しやすくなることがある。[11.1.2参照]
9.1.2 重篤な心疾患又はその既往歴のある患者
薬理作用から心拍数低下を起こす可能性がある。
9.1.3 低血圧症の患者
症状が悪化することがある。
9.2 腎機能障害患者
9.2.1 重度の腎障害(クレアチニンクリアランス30mL/分未満)のある患者
主として腎臓で排泄される。また、これらの患者を対象とした臨床試験は実施していない。なお、血液透析を受けている患者に対して、透析による用量調節の必要性はない。
9.3 肝機能障害患者
主として肝臓で代謝される。また、これらの患者を対象とした臨床試験は実施していない。
9.5 妊婦
妊婦又は妊娠している可能性のある女性には使用しないこと。動物実験(ラット)で胎児毒性(体重減少、死亡数増加及び指の奇形)が報告されている。[2.2参照]
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。ヒトにおいて血漿中プロラクチン濃度の低下が認められることが報告されており、乳汁分泌が抑制されるおそれがある。また、動物実験(ラット)で乳汁中に移行することが報告されている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。
9.8 高齢者
一般に生理機能が低下している。
10. 相互作用
相互作用序文
主にCYP1A2により代謝される。
薬物代謝酵素用語
CYP1A2
10.2 併用注意
| ドパミン拮抗剤 抗精神病薬 メトクロプラミド スルピリド等 | 本剤の作用が減弱することがある。 | 本剤はドパミン受容体作動薬であり、併用により両薬剤の作用が拮抗するおそれがある。 |
| CYP1A2阻害作用を有する薬剤 シプロフロキサシン フルボキサミン等 | ロピニロール速放錠とシプロフロキサシンとの併用によりロピニロールのCmax及びAUCがそれぞれ約60%及び84%増加したことが報告されている。本剤使用中にこれらの薬剤を投与開始又は中止する場合は、必要に応じて本剤の用量を調整すること。 | これらの薬剤のCYP1A2阻害作用により、本剤の血中濃度が上昇する可能性がある。 |
| エストロゲン含有製剤 | 高用量のエストロゲンを投与した患者でロピニロールの血中濃度上昇がみられたとの報告があるので、本剤使用中に高用量のエストロゲンを投与開始又は中止する場合は、必要に応じて本剤の用量を調整すること。 | 機序不明 |
| 抗パーキンソン剤 レボドパ 抗コリン剤 アマンタジン塩酸塩 ドロキシドパ エンタカポン セレギリン塩酸塩 ゾニサミド等 [11.1.2参照] | ジスキネジア、幻覚、錯乱等の副作用が増強することがある。 | 相互に作用が増強することがある。 |
11. 副作用
11.1 重大な副作用
次の副作用があらわれることがあるので、観察を十分に行い、異常が認められた場合には使用を中止するなど適切な処置を行うこと。
11.1.1 突発的睡眠(0.7%)、極度の傾眠(頻度不明)
前兆のない突発的睡眠、極度の傾眠があらわれることがある。[1.、8.1参照]
11.1.2 幻覚(3.6%)、妄想(0.4%)、興奮(0.1%)、錯乱(頻度不明)、譫妄(0.7%)
11.1.3 悪性症候群(頻度不明)
使用後、減量後又は中止後に、高熱、意識障害、高度の筋硬直、不随意運動、ショック症状等があらわれることがある。このような症状があらわれた場合には、使用開始初期の場合は中止し、また、継続使用中の用量変更・中止時の場合は一旦もとの使用量に戻した後、慎重に漸減し、体冷却、水分補給等の適切な処置を行うこと。なお、使用継続中にも同様の症状があらわれることがある。[8.3参照]
11.2 その他の副作用
| 5%以上 | 1%以上5%未満 | 1%未満 | 頻度不明 | |
| 精神神経系 | 傾眠、ジスキネジア | 幻視、浮動性めまい、体位性めまい、頭痛、不眠 | 錯覚、ジストニア、幻聴、リビドー亢進、回転性めまい | 衝動制御障害(病的賭博、病的性欲亢進、強迫性購買、暴食等)、躁状態 |
| 肝臓 | ALT上昇、AST上昇、γ-GTP上昇 | 肝機能異常、ビリルビン上昇、AL-P上昇 | ||
| 筋・骨格系 | 姿勢異常、CK上昇 | 背部痛 | ||
| 循環器 | 起立性低血圧、起立血圧低下 | 上室性期外収縮、心室性期外収縮、動悸、低血圧、血圧上昇 | ||
| 消化器 | 悪心、便秘 | 食欲不振、嘔吐、腹部不快感 | 下痢、消化不良 | |
| 腎臓 | 尿潜血陽性 | BUN上昇、尿蛋白陽性 | ||
| 皮膚 | 適用部位紅斑、適用部位そう痒感 | 適用部位皮膚炎、適用部位発疹、適用部位刺激感、適用部位腫脹、適用部位色素沈着 | ||
| 過敏症 | 発疹、湿疹、そう痒、顔面浮腫、じん麻疹 | |||
| その他 | けん怠感、末梢性浮腫、LDH上昇 | 異常感、転倒、胸部不快感、浮腫、口渇、挫傷、咳嗽、好酸球増加、尿糖陽性 | 薬剤離脱症候群注)(無感情、不安、うつ、疲労感、発汗、疼痛等) |
13. 過量投与
13.1 症状
悪心、嘔吐、不随意運動、錯乱、痙攣等のドパミン作用に関連する症状の発現が予想される。
13.2 処置
過量投与が疑われる場合には、速やかに剥離すること。ドパミン拮抗剤(抗精神病薬、メトクロプラミド等)投与により症状が軽減することがある。
14. 適用上の注意
14.1 薬剤交付時の注意
14.1.1 貼付時
(1)使用する際にはライナーを剥がして使用すること。
(2)1日毎に貼り替えるため、貼付開始時刻の設定にあたって入浴等の時間を考慮することが望ましい。
14.1.2 保管・廃棄
(1)小児の手の届かない場所に保管すること。
(2)貼付24時間後も成分が残っているので、使用済みの製剤は接着面を内側にして折りたたみ、小児の手及び目の届かない所に安全に廃棄すること。
14.2 薬剤投与時の注意
14.2.1 創傷面又は湿疹・皮膚炎等がみられる部位は避けて貼付すること。
14.2.2 貼付部位の皮膚を拭い、清潔にしてから貼付すること。また、貼付部位の水分は十分に取り除くこと。
14.2.3 貼付による皮膚刺激を避けるため、貼付箇所を毎回変更すること。
14.3 薬剤投与中の注意
14.3.1 途中で剥がれ落ちた場合は、直ちに新たな本剤を貼付すること。また、次の貼り替え予定時間には新たな本剤に貼り替えること。
14.3.2 貼付部位を外部熱(過度の直射日光、あんか、サウナなどのその他の熱源)に曝露させないこと。貼付部位の温度が上昇すると本剤の血中濃度が上昇するおそれがある。
15. その他の注意
15.2 非臨床試験に基づく情報
動物実験(ラット)で1.5〜50mg/kg/日の2年間投与により、精巣Leydig細胞の過形成、腺腫の発生頻度が用量依存的に増加したとの報告がある。なお、マウスではがん原性は認められていない。
16. 薬物動態
16.1 血中濃度
16.1.1 単回投与
健康成人男性12例を対象に本剤(ロピニロール塩酸塩として1.2及び4.8mg注))を胸部に24時間単回投与した際、血漿中ロピニロールの薬物動態パラメータ(Cmax、AUC0-t及びAUC0-∞)の1.2〜4.8mg間における線形性が確認された1)。
血漿中ロピニロール濃度推移(平均値+標準偏差、11〜12例)
| 投与量 (例数) | Cmax(ng/mL) | AUC0-t(ng・hr/mL) | AUC0-∞(ng・hr/mL) | tmaxa)(hr) | t1/2(hr) |
| 1.2mg (12) | 0.254±0.0855 | 6.66±2.48 | 6.86±2.47 | 20.0,24.0 | 8.44±2.07 |
| 4.8mg (11) | 1.02±0.279 | 27.8±8.33 | 28.1±8.28 | 20.0 | 16.0±8.34 |
16.1.2 反復投与
(1)パーキンソン病患者24例を対象に本剤(ロピニロール塩酸塩として6.8、13.5又は20.3mg注))を胸部に1日1回7日間反復投与した際、血漿中ロピニロールの薬物動態パラメータ(Cmax及びAUC0-24)は、6.8〜20.3mg間でほぼ投与量に比例して増加することが確認された。また、血漿中ロピニロール濃度はおおむね投与開始後48〜72時間で定常状態に達した2)。
| 投与量 (例数) | Cmax(ng/mL) | AUC0-24(ng・hr/mL) | tmaxa)(hr) | t1/2(hr) | |
| 1日目 | 6.8mg (8) | 2.17±1.03 | 27.9±14.9 | 24.0 | − |
| 13.5mg (8) | 2.89±0.567 | 33.1±6.13 | 24.0 | − | |
| 20.3mg (8) | 5.91±1.31 | 89.4±30.0 | 16.0,20.0 | − | |
| 7日目 | 6.8mg (8) | 1.88±0.966 | 38.5±20.6 | 20.0 | 20.3±4.84 |
| 13.5mg (7) | 4.21±3.31 | 84.8±69.5 | 24.0 | 20.8±4.03 | |
| 20.3mg (7) | 7.16±4.40 | 154±104 | 16.0 | 19.0±4.30 |
(2)用量と血漿中濃度との関係
パーキンソン病患者199例を対象に本剤(ロピニロール塩酸塩として8〜64mg)を任意漸増法にて1日1回長期投与した際、投与2、4、8、12、24及び52週の血漿中ロピニロール濃度の8〜64mg間における線形性が確認された。(パワーモデル:log(y)=−0.721+1.075・log(x))3)
16.2 吸収
16.2.1 単回投与
健康成人男性15例を対象に本剤(ロピニロール塩酸塩として4.8mg注))を胸部、腹部、側腹部、大腿部及び上腕部にそれぞれ24時間単回投与した際、各投与部位間における幾何平均値の比(推定値)は、AUC0-tで0.738〜1.308、Cmaxで0.763〜1.295であり、各投与部位間の血漿中ロピニロール濃度に大きな差はないと考えられた。また、tmax(最頻値)は各投与部位において20.0〜24.0hr、t1/2(平均値)は10.5〜11.5hrであり、いずれの投与部位においても同様の値を示した4)。
16.3 分布
16.3.1 血漿蛋白結合
[14C]ロピニロール塩酸塩のヒト血漿蛋白結合率は35〜42%であることが報告されている5)(in vitro)。
16.3.2 胎児・乳汁移行
[14C]ロピニロール塩酸塩を妊娠ラットに反復経口投与したとき、胎児中へ放射能の移行が認められた。また、授乳期ラットにおいては乳汁中への移行が認められた5)。
16.4 代謝
16.5 排泄
健康成人男性12例を対象に本剤(ロピニロール塩酸塩として1.2及び4.8mg注))を胸部に24時間単回投与した際、投与開始後0〜96時間のロピニロールの累積尿中排泄率(平均値)は1.2mg投与時3.4%、4.8mg投与時3.6%であった1)。
注)本剤の承認された1日量は8〜64mgである。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第II相試験(二重盲検比較試験)
L-DOPA非併用パーキンソン病患者を対象に本剤(ロピニロール塩酸塩として6.8〜54.0mg注))を1日1回16週間反復投与した結果、最終評価時におけるUPDRS(Unified Parkinson's Disease Rating Scale)part III合計スコアの変化量において、プラセボ群に対し有意に改善した。副作用発現頻度は62.9%(88/140例)で、主な副作用は、悪心17.1%(24/140例)、傾眠及び適用部位紅斑 各13.6%(19/140例)等であった8)。
注)本剤の承認された1日量は8〜64mgである。
| 投与群 (例数) | 投与前値a) | 最終評価時a) | 変化量b) | 優越性 プラセボに対する差c) (95%CI) | |
| 本剤 (136) | 21.2±7.1 | 12.9±8.1 | −8.4±0.5 | −4.8 (−6.5,−3.2) | p<0.0001 |
| プラセボ (69) | 21.5±7.5 | 18.0±9.8 | −3.5±0.7 | ||
17.1.2 国内第III相試験(二重盲検検証試験)
L-DOPA併用パーキンソン病患者を対象に本剤(ロピニロール塩酸塩として8〜64mg)を1日1回16週間反復投与した結果、最終評価時におけるUPDRS part III合計スコアの変化量において、プラセボ群に対し優越性を示すとともに、ロピニロール塩酸塩徐放錠(ROP:ロピニロールとして2〜16mg)に対し非劣性を示した。副作用発現頻度は54.0%(122/226例)で、主な副作用は、適用部位紅斑10.2%(23/226例)、傾眠9.7%(22/226例)、悪心8.8%(20/226例)等であった9)。
| 投与群 (例数) | 投与前値a) | 最終評価時a) | 変化量b) | 優越性 プラセボに対する差c) (95%CI) | 非劣性ROPに対する差c) (95%CI) |
| 本剤 (172) | 24.6±9.0 | 14.6±9.5 | −9.8±0.5 | −5.4 (−7.3,−3.6) p<0.0001 | 0.3 (−1.2,1.8)d) |
| プラセボ (85) | 24.6±9.1 | 20.2±10.4 | −4.3±0.8 | ||
| ROP (171) | 24.5±8.5 | 14.4±9.0 | −10.1±0.5 |
17.1.3 国内第III相試験(長期投与試験)
パーキンソン病患者(ドパミンアゴニスト使用患者を含む)を対象に、本剤(ロピニロール塩酸塩として8〜64mg)を1日1回長期投与(52週間)した際の有効性を検討した結果、UPDRS part III合計スコアの変化量は、L-DOPA併用パーキンソン病患者、L-DOPA非併用パーキンソン病患者のいずれにおいても16週まで減少し、その後52週までほぼ一定に推移した。なお、ドパミンアゴニスト使用患者は以下の換算表に基づく本剤投与量より投与を開始し、患者の症状に応じて適宜用量を調整した。副作用発現頻度は72.4%(144/199例)で、主な副作用は、適用部位紅斑26.6%(53/199例)、適用部位そう痒感21.1%(42/199例)、傾眠13.1%(26/199例)等であった3)。
| 対象患者 (例数) | 投与前値 | 最終評価時 | 変化量 |
| L-DOPA併用 (95) | 23.6±8.3 | 13.5±9.9 | −10.1±7.8 |
| L-DOPA非併用 (103) | 22.8±9.0 | 14.7±9.5 | −8.1±8.6 |
| ドパミンアゴニスト | 用量(mg/日) | |||||||
| ロピニロール(速放錠) | 〜2.25 | 3〜4.5 | 6 | 7.5〜9 | 10.5 | 12 | 13.5 | 15 |
| ロピニロール(徐放錠) | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 |
| プラミペキソール塩酸塩水和物(速放錠) | 〜0.5 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0〜 |
| プラミペキソール塩酸塩水和物(徐放錠) | 0.375 | 0.75 | 1.5 | 2.25 | 3.0 | − | 3.75 | 4.5 |
| カベルゴリン | 〜1.0 | 1.5 | 2〜2.5 | 3 | − | − | − | − |
| ロチゴチン | 4.5 | 9 | 13.5 | 18 | 22.5 | 27 | 31.5 | 36 |
| ↓ | ↓ | ↓ | ↓ | ↓ | ↓ | ↓ | ↓ | |
| 本剤 | 8 | 16 | 24 | 32 | 40 | 48 | 56 | 64 |
18. 薬効薬理
18.1 作用機序
ロピニロール塩酸塩はドパミンの構造をもとに創製された非麦角系ドパミンアゴニストであり、ドパミンD2様受容体を刺激することにより抗パーキンソン病作用を示す10)。
18.2 ドパミン受容体に対する作用
18.3 ドパミン受容体刺激作用
ドパミン神経を片側性に破壊したラットにおいて、ロピニロールは用量依存的に破壊反対側への旋回行動を増加させた13)。
18.4 パーキンソン病モデル動物に対する作用
MPTP誘発サルパーキンソン病モデルにおいて、本剤を7日間反復投与すると、投与後1日からパーキンソニズムスコアが低下し、投与後3日にはさらにスコアが低下し、投与後7日まで低いスコアが持続した14)。
19. 有効成分に関する理化学的知見
19.1. ロピニロール塩酸塩
21. 承認条件
医薬品リスク管理計画を策定の上、適切に実施すること。
22. 包装
<ハルロピテープ8mg>
28枚[1枚/1袋×28袋]
<ハルロピテープ16mg>
28枚[1枚/1袋×28袋]
<ハルロピテープ24mg>
28枚[1枚/1袋×28袋]
<ハルロピテープ32mg>
28枚[1枚/1袋×28袋]
<ハルロピテープ40mg>
28枚[1枚/1袋×28袋]
23. 主要文献
- 久光製薬社内資料.第I相単回及び反復投与試験(2019年9月20日承認、CTD2.7.6.2)
- 久光製薬社内資料.第II相パーキンソン病患者反復投与試験(2019年9月20日承認、CTD2.7.6.4)
- 久光製薬社内資料.第III相長期投与試験(2019年9月20日承認、CTD2.7.6.8)
- 久光製薬社内資料.第I相投与部位検討試験(2019年9月20日承認、CTD2.7.6.1)
- Ramji J,et al., 薬理と治療, 24 (Suppl 11), 1765-78, (1996)
- Ramji JV,et al., Xenobiotica, 29 (3), 311-25, (1999) »PubMed
- Bloomer JC,et al., Drug Metab Dispos, 25 (7), 840-4, (1997) »PubMed
- 久光製薬社内資料.第II相L-DOPA非併用患者比較試験(2019年9月20日承認、CTD2.7.6.6)
- 久光製薬社内資料.第III相比較試験(2019年9月20日承認、CTD2.7.6.7)
- 新井裕幸 ほか, 日本薬理学雑誌, 130 (4), 313-9, (2007) »PubMed
- Millan MJ,et al., J Pharmacol Exp Ther., 303 (2), 791-804, (2002) »PubMed
- Coldwell MC,et al., Br J Pharmacol., 127 (7), 1696-702, (1999) »PubMed
- Reavill C,et al., J Pharm Pharmacol., 52 (9), 1129-35, (2000) »PubMed
- 久光製薬社内資料.サルパーキンソン病モデルを用いた薬理試験(2019年9月20日承認、CTD2.6.2.2.1)
24. 文献請求先及び問い合わせ先
文献請求先
協和キリン株式会社
くすり相談窓口
〒100-0004
東京都千代田区大手町1-9-2
電話:0120-850-150 受付時間 9:00〜17:30(土・日・祝日及び弊社休日を除く)
製品情報問い合わせ先
協和キリン株式会社
くすり相談窓口
〒100-0004
東京都千代田区大手町1-9-2
電話:0120-850-150 受付時間 9:00〜17:30(土・日・祝日及び弊社休日を除く)
26. 製造販売業者等
26.1 製造販売元
久光製薬株式会社
〒841-0017
鳥栖市田代大官町408番地
26.2 発売元
協和キリン株式会社
東京都千代田区大手町1-9-2